河北医科大学第四医院肾内科徐金升教授团队揭示srebp1–iaspp轴通过抑制铁死亡缓解ckd血管钙化。
血管钙化( Vascular calcification , VC )在慢性肾脏病( Chronic kidney disease , CKD )患者中较为常见,且严重影响血管的结构和功能。铁死亡作为一种由铁催化的活性氧和脂质过氧化引起的程序性细胞死亡方式曾被报道参与其中,但上游调控机制尚不清楚。
2025 年 6 月,来自河北医科大学第四医院肾内科的徐金升教授团队在《 Cardiovascular Diabetology 》 杂志【中科院分区 1 区( Top 期刊), IF=10.6 分】发表 s 了题为“ SREBP1 deficiency aggravates vascular calcification via iASPP-triggered ferroptosis of vascular smooth muscle cells ”的文章,系统阐明了 SREBP1–iASPP 轴通过抑制脂质过氧化驱动的铁死亡,从而缓解 VC 的分子机制。

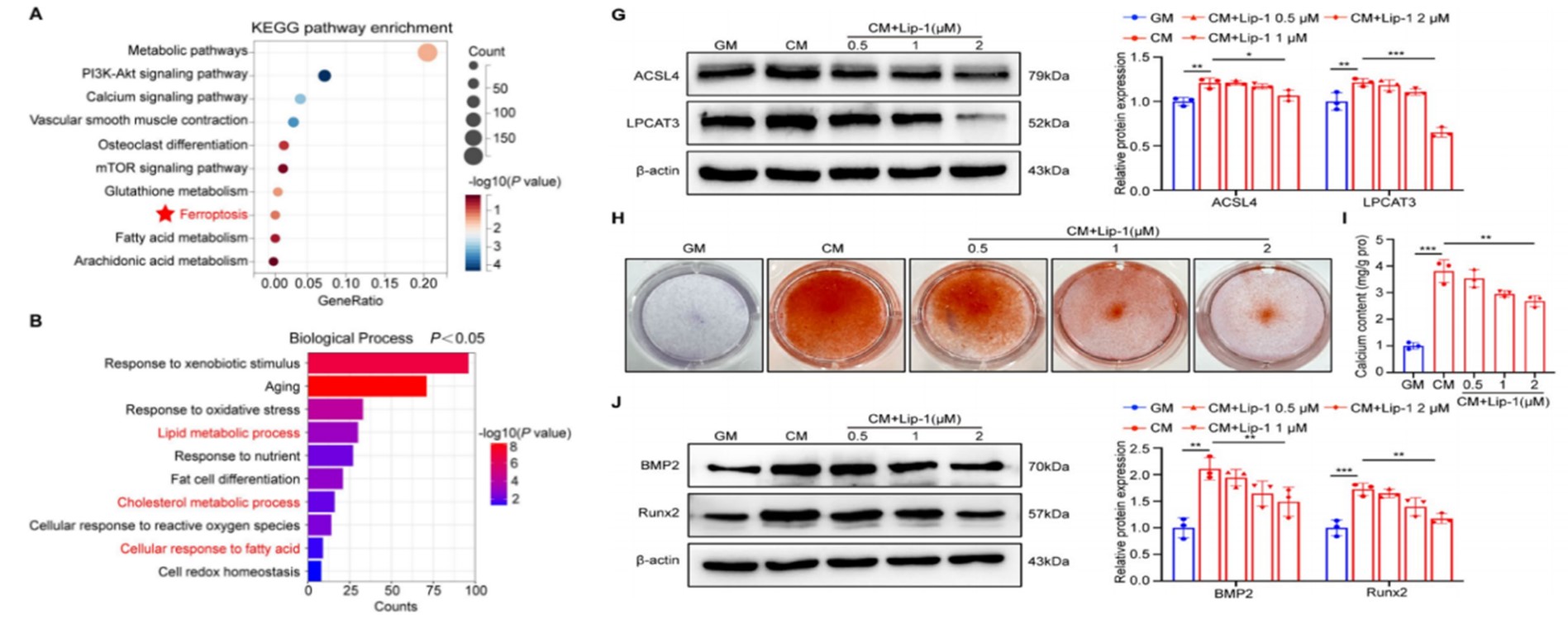
研究者首先利用血管钙化 GEO 公共数据集( GSE74755 )分析发现脂代谢相关的铁死亡可能是 VC 的重要生物学过程。接下来在体外模型中验证了在高磷诱导的血管平滑肌细胞( VSMCS )中给予铁死亡抑制剂 Lip-1 ,抑制了多不饱和脂肪酸( PUFAs )的异常蓄积,阻断了脂质过氧化反应,降低了细胞内钙化水平, 证实脂质过氧化驱动的铁死亡是 VC 的关键促发因素。 (图 1 )
图1 铁死亡相关脂质代谢途径参与VSMCs钙化
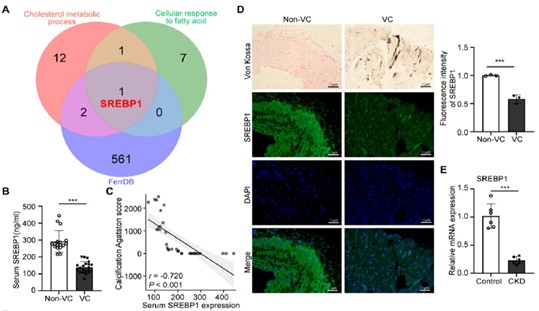
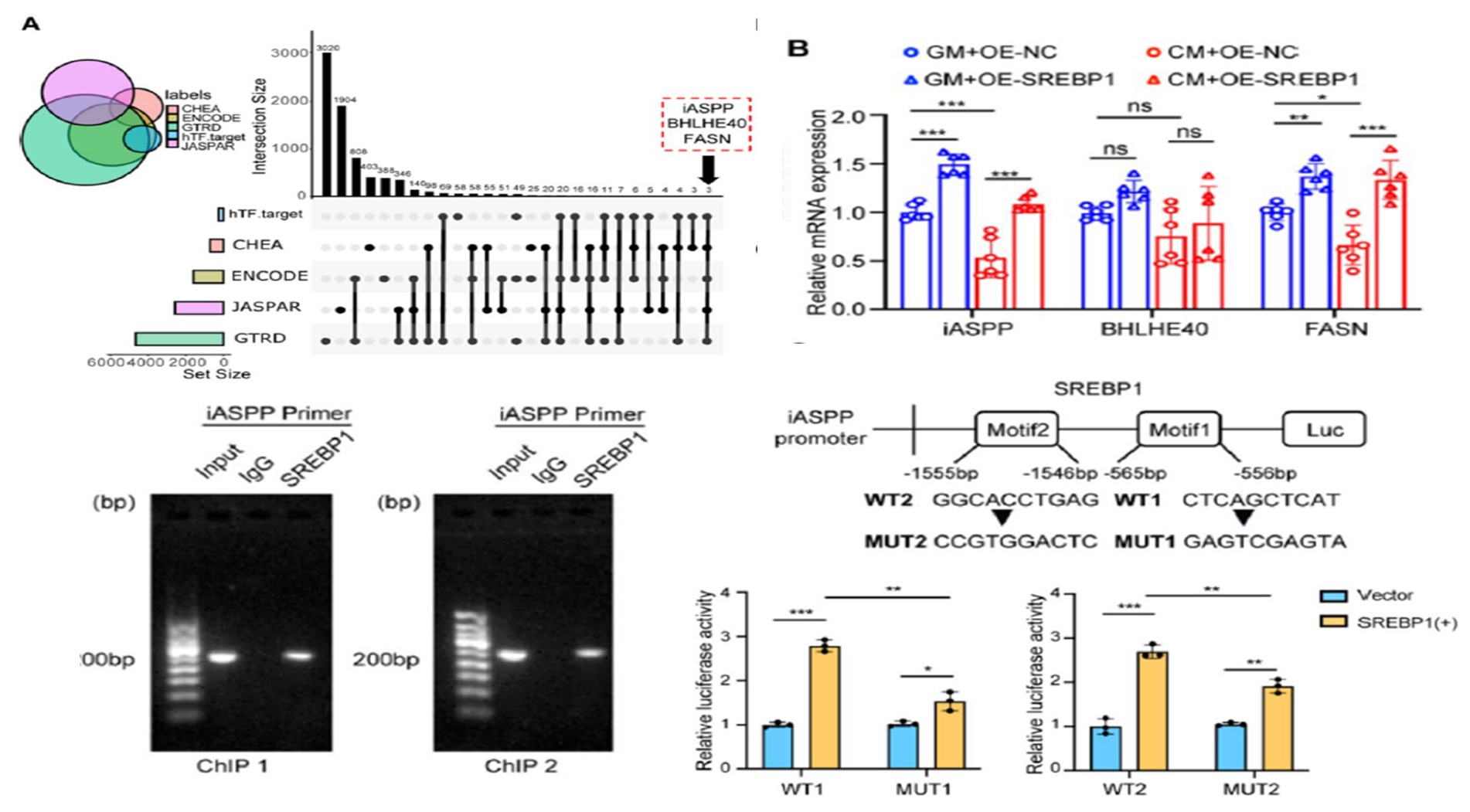
那么是什么脂代谢调控基因与此过程相关性最高呢?研究者发现在“脂质代谢”与“血管钙化”和“铁死亡”交集基因中,SREBP1位居前列。随后,研究者检测了VC患者血清及桡动脉组织,发现SREBP1表达水平显著降低,且与钙化积分呈负相关。(图2)
图2 SREBP1 的降低与血管钙化风险增加有关
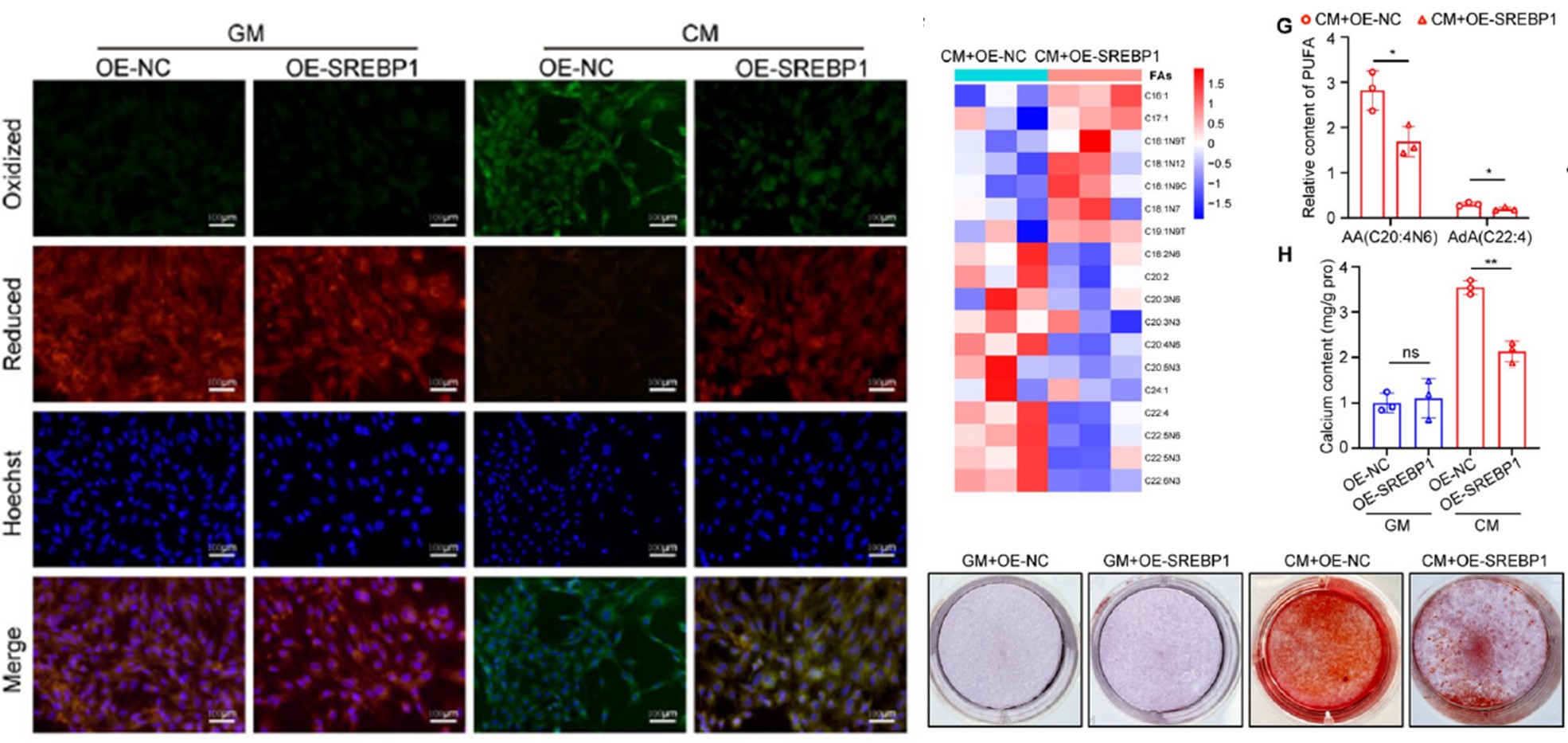
研究者接下来在体外模型中验证了SREBP1的功能。在高磷诱导的VSMCs中,过表达SREBP1可以显著抑制脂质过氧化驱动的铁死亡和钙化水平,这证明了SREBP1可抑制高磷诱导的VSMCs钙化作用。(图3)
图3 在体外钙化模型中,SREBP1抑制铁死亡和钙化过程
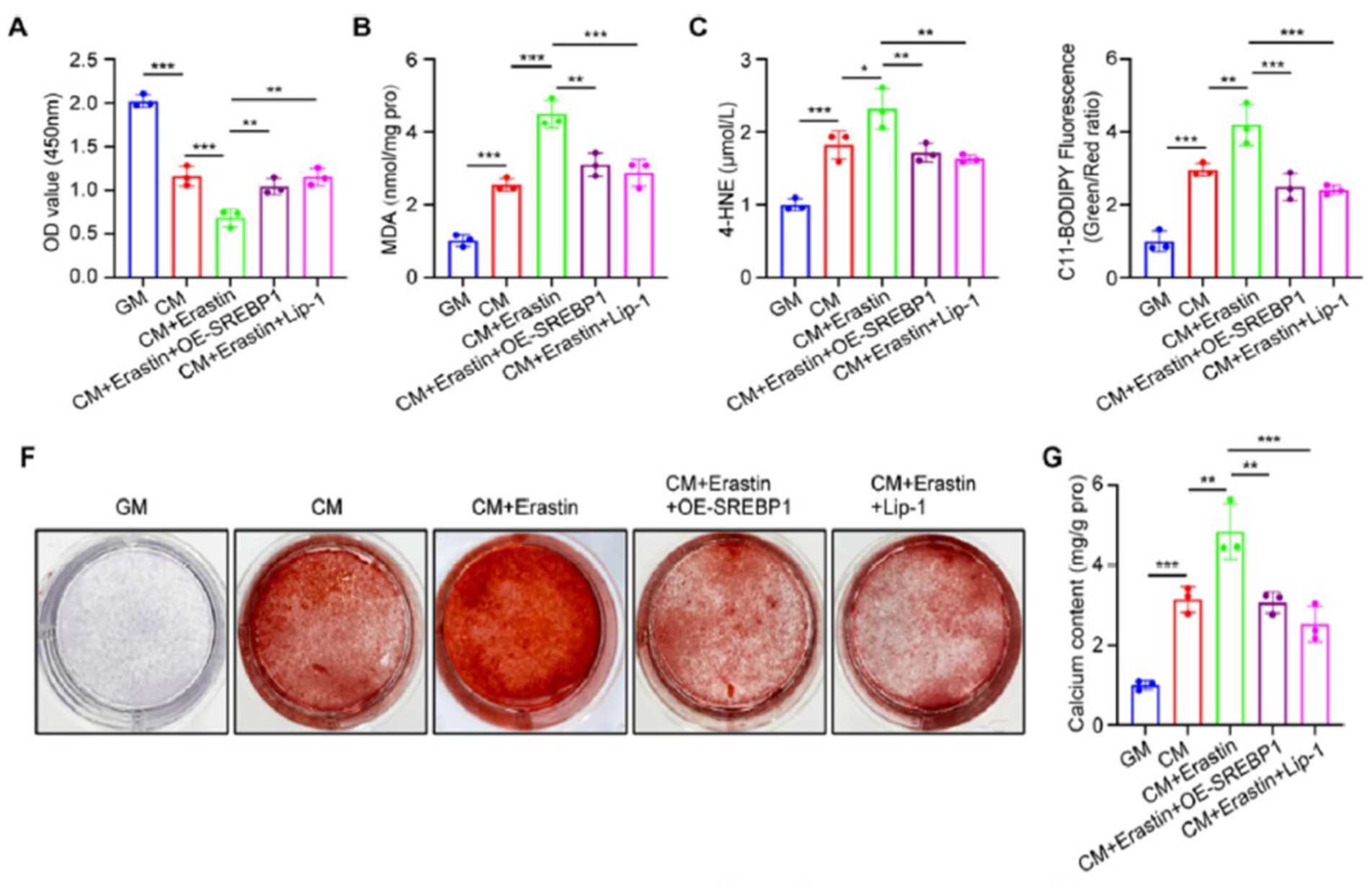
那么SREBP1是通过什么方式抑制血管钙化的呢?是否通过了铁死亡通路?研究者使用经典铁死亡诱导剂Erastin,发现其显著加剧了细胞内钙盐沉积;而过表达SREBP1或给予铁死亡抑制剂Lip-1均可阻断该效应,证明SREBP1通过抑制铁死亡发挥抑制血管钙化作用。(图4)
图 4 SREBP1通过调控铁死亡抑制钙化
那么SREBP1抑制铁死亡的分子机制是什么?研究者首先通过生信分析预测了SREBP1的下游效应基因,并通过RT-qPCR明确了变化最显著的iASPP。研究者进一步通过ChIP-PCR证明SREBP1可以分别与iASPP启动子区的两个位点结合。并根据结合位点构建的突变载体的双荧光素酶报告基因明确SREBP1促进了iASPP的转录活性。(图5)
图5 SREBP1直接转录激活iASPP
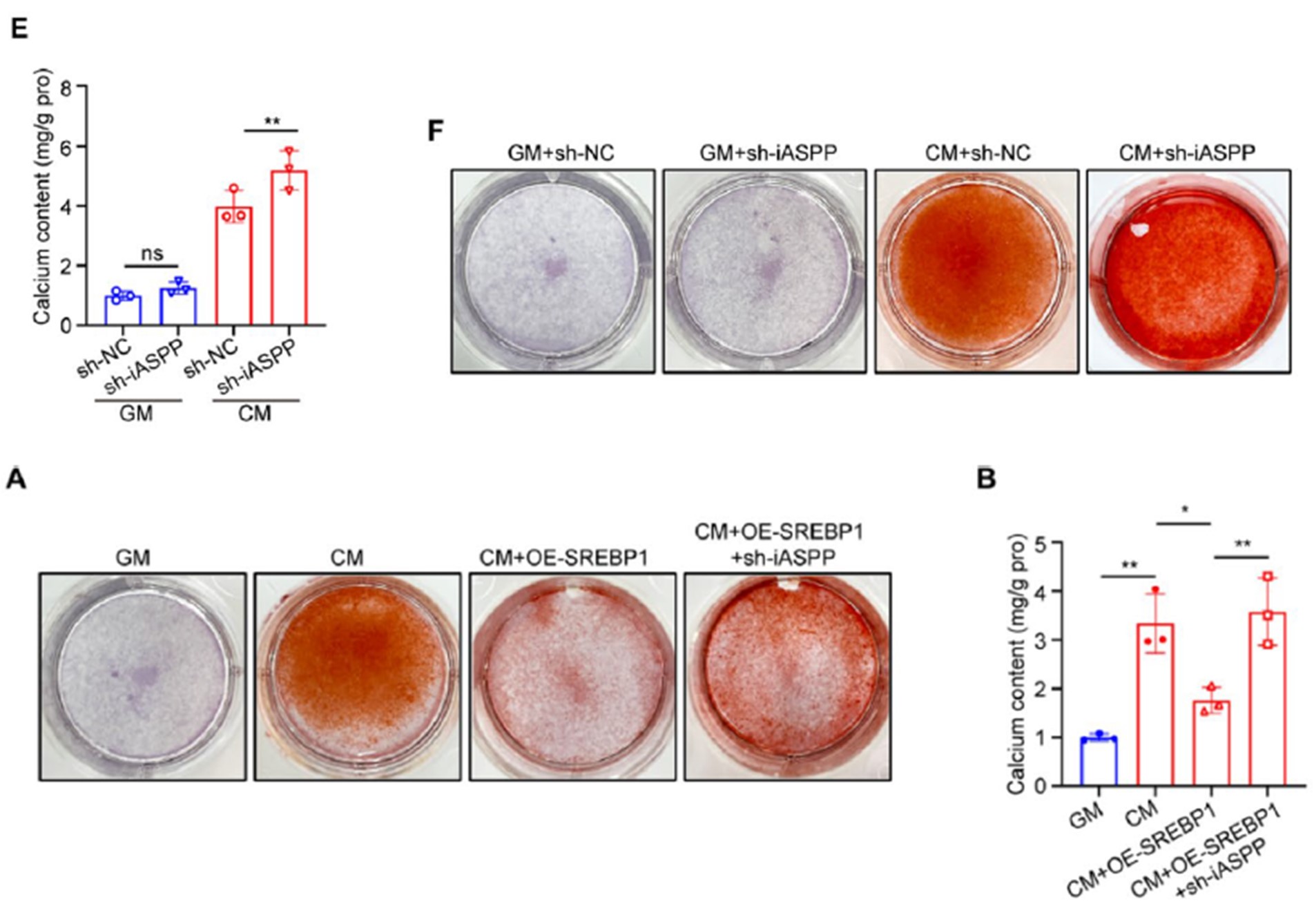
研究者接下来在体外模型中验证了iASPP的功能。在高磷诱导的VSMCs中,敲低iASPP可以显著促进铁死亡和钙化水平。进一步在过表达SREBP1的基础上敲低iASPP可以逆转SREBP1的保护作用,证明了SREBP1发挥抑制血管钙化是通过iASPP来实现的。(图6)
图6 在体外模型中,SREBP1通过iASPP发挥血管保护作用
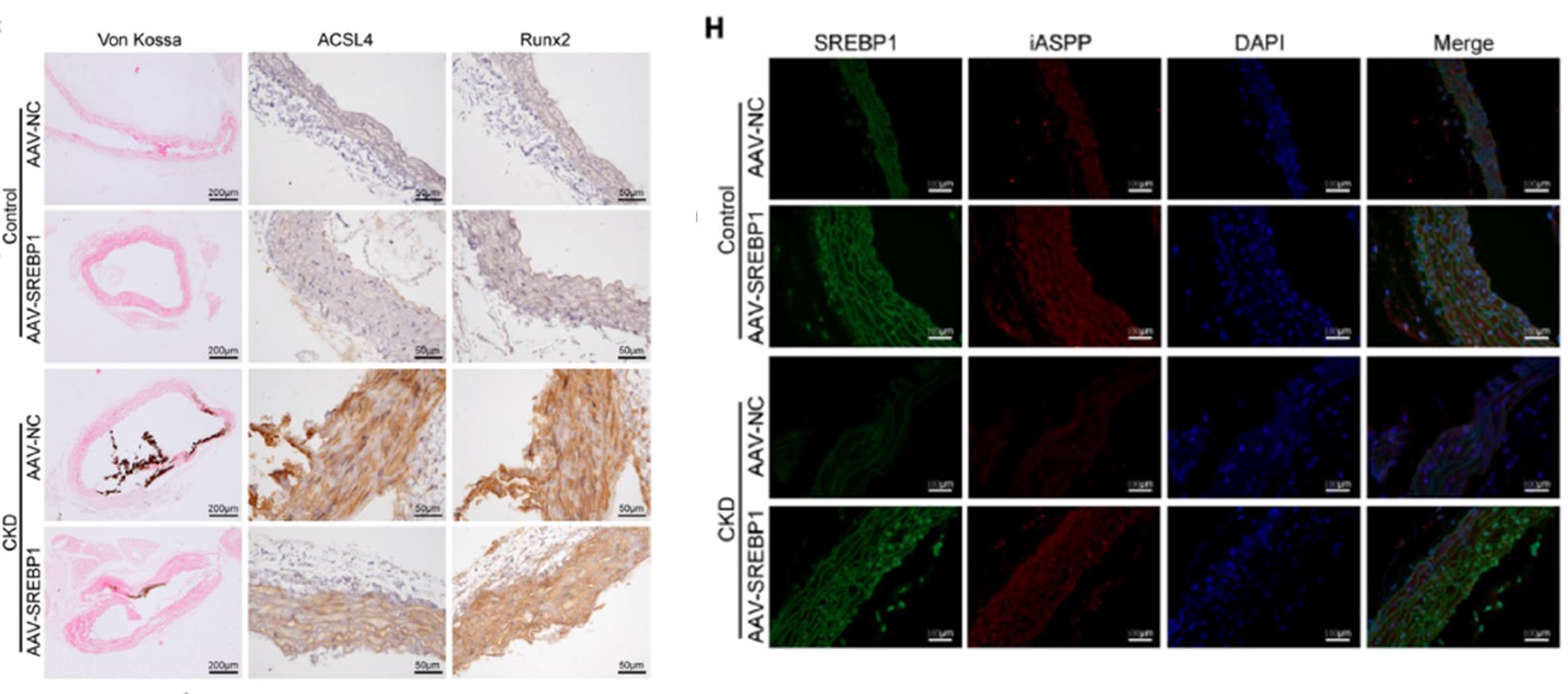
最后,研究者进一步在体内血管钙化模型中验证了SREBP1介导铁死亡对小鼠血管钙化的影响。研究者使用了SREBP1的腺相关病毒(AAV-SREBP1)处理CKD小鼠,发现AAV-SREBP1处理后,大鼠血管钙化程度显著减轻,铁死亡水平也显著降低。在体外再次证明了SREBP1通过抑制铁死亡来减轻CKD小鼠血管钙化的。(图7)
图7 SREBP1抑制CKD小鼠的血管钙化
文章结论与展望
综上,该研究通过“临床现象-动物模型-细胞机制”三级递进策略,系统阐明了SREBP1通过转录激活iASPP抑制铁死亡,进而减轻血管钙化的分子机制。该成果不仅深化了对CKD患者VC发病机制的理解,更为开发基于脂质代谢调控的新型抗血管钙化治疗策略提供了坚实依据。未来研究需进一步验证其临床转化潜力,并探索联合用药方案以提升疗效。
程美娟、靳晶晶、张胜雷