抗gbm肾病伴急性肾小管-间质肾炎1例
【病例摘要】
患者男性,25岁,汉族,主因“反复低热1月,恶心呕吐半月”于2024-3-11首次入院。
现病史:
患者于2024-2-11出现发热,体温37.3-38.5℃波动,伴有咳嗽、咳痰,于当地诊所输液治疗(具体不详)后未见好转。
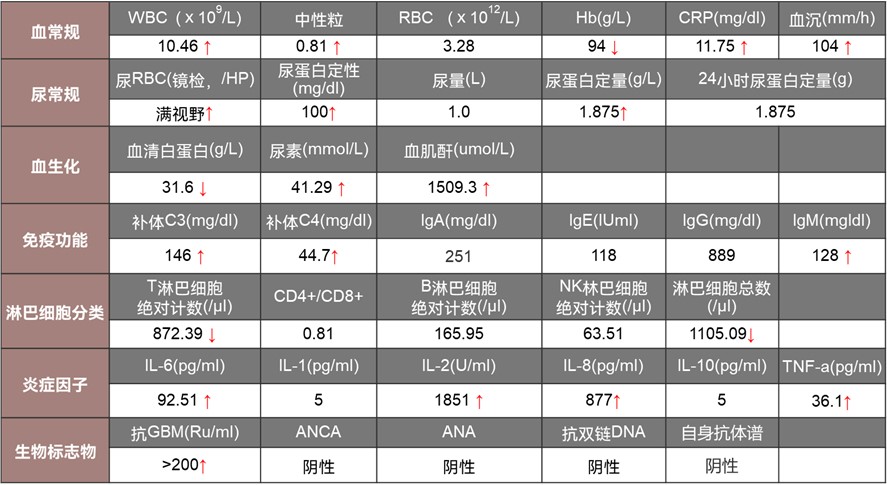
2024-2-26至唐山某医院就诊,入住感染科,查血常规:白细胞计数13.53×109/L↑,中性粒细胞0.88 ↑ ,血红蛋白测定113g/L↓,CRP 85.95mg/l ↑ ;PCT 0.3ng/ml ,ESR 82mm/h,SCr 230.9umol/L。尿常规:RBC 95.2/HPF,WBC 6.1/HPF;痰培养:草绿色链球菌+粘膜奈瑟氏菌。超声提示:双肾饱满,实质回声增高;肝脏实质回声增强,脾体积饱满。予以抗感染、护胃、补液支持治疗,复查血肌酐逐渐升高,患者于2024-2-28出院。
2024-2-29及3月1日:当地诊所使用激素静滴治疗(每日一次,具体用药剂量不详)。2024-3-1患者出现出现恶心、呕吐较为明显,伴有间断鼻粘膜少量出血,至秦皇岛某院住院,查血SCr:313.35umol/L,ALB:32g/L,24小时尿蛋白:659.92mg/24h(2L)。予以莫西沙星抗感染等治疗,并行肾脏穿刺活检,结果显示“抗GBM抗体肾小球肾炎(I型新月体性肾小球肾炎;急性肾小管-间质肾炎)”。血清抗GBM阳性,未予激素或免疫抑制剂等治疗。
2024-3-6患者至我院门诊就诊,查血常规:白细胞计数13.53×109/L ↑ ,中性粒细胞0.777 ↑ ,血红蛋白 100g/L ↓ ,C-反应蛋白 8.523mg/dl ↑ ,IL-6 53.71pg/ml ↑ ;生化:尿素 24.98mmol/L ↑ ,肌酐 675.8umol/L ↑ ,血清尿酸514.8umol/L ↑ ,无机磷1.81mmol/L ↑ ,二氧化碳19.8mmol/L↓。门诊以“急进性肾炎综合征”收入院。患者发病以来反复低热,时有咳嗽、咳痰,自觉乏力,恶心,间断呕吐,食欲差,睡眠正常,大便不成形,入院前两日排尿较前减少,约1000ml/日。
个人史、家族史:
无吸烟及饮酒史,已婚,育1男,家族中无传染病及遗传病史。
【入院前后相关检查】
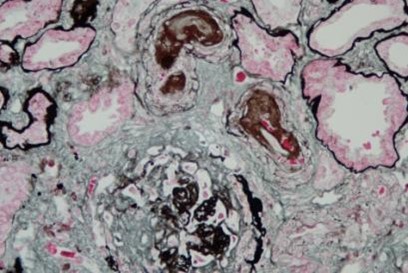
首次肾活检报告(外院2024-3-4)
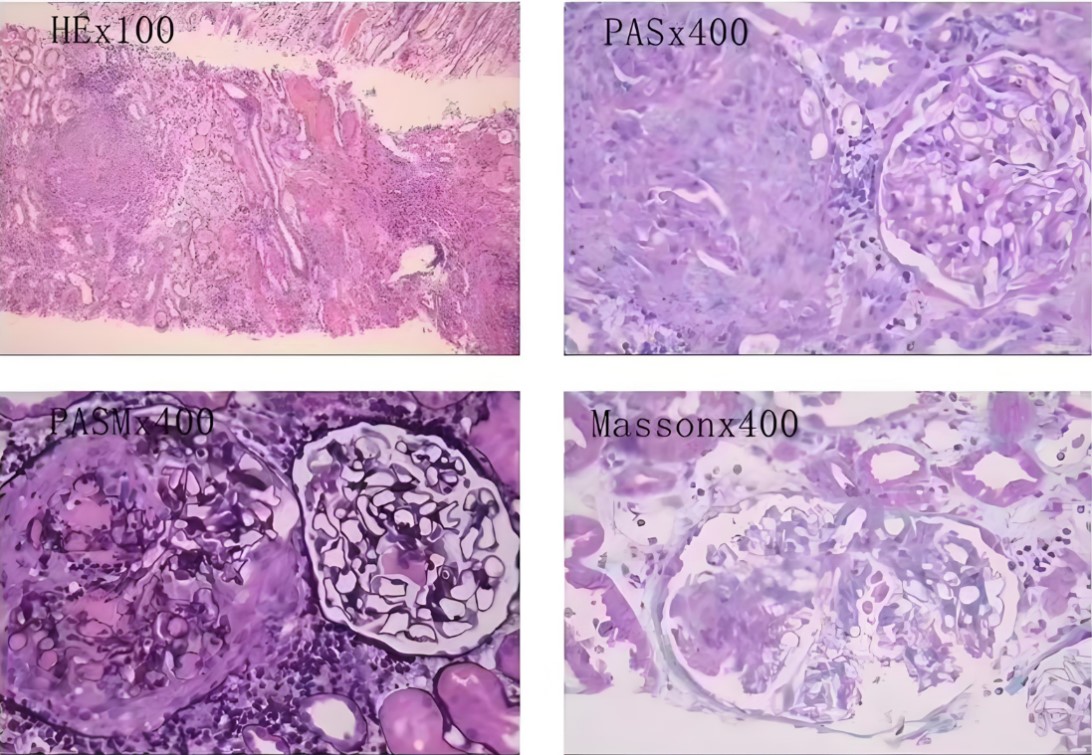
光镜:可见36个肾小球,未见肾小球球性硬化及节段性硬化。肾小球中可见14个细胞性、6个细胞纤维性、3个小细胞性新月体形成,节段毛细血管襟及鲍曼囊壁断裂、皱缩,可见少量炎细胞浸润,节段性可见纤维素样坏死,肾小球系膜细胞和基质轻度节段性增生,无明显嗜复红蛋白沉积。肾小管上皮细胞颗粒变性,可见较多红细胞管型及蛋白管型,灶状肾小管管腔扩张伴节段性上皮细胞扁平、脱落,刷毛缘消失,少数肾小管萎缩,肾间质多灶状淋巴、单核细胞浸润及灶状浆细胞、小灶状中性粒细胞、嗜酸性粒细胞浸润,小动脉管壁节段性增厚。
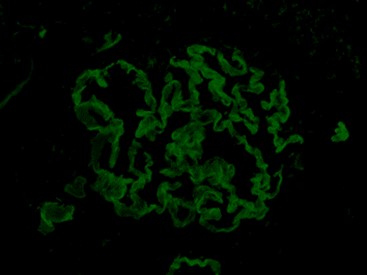
免疫荧光:
免疫荧光:IgG(+++);IgA(阴性);IgM(+/-);C3(+++);Clq(阴性);IgG1(+++);IgG2(+);IgG3(+/-);IgG4(+);PLA2R(阴性);NELL-1(阴性)
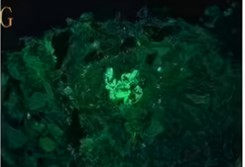
肾小球:弥漫、球性、沿毛细血管襻呈线性


电镜:
免疫荧光:IgG(+++)沿毛细血管襻呈线性沉积。
超微结果:肾小球基底膜节段性增厚,足突大部分融合,个别系膜区可见电子致密物沉积。
入院时化验检查:
入院时辅助检查:
心电图:窦性心律,T波高尖,ST段抬高(II、III、AVF);
超声心动图:EF 66%,左房轻度增大,二尖瓣少量反流;
泌尿系超声:双肾实质回声增强,大小形态如常;
肝胆胰脾超声未见明显异常;
胸部CT:右侧叶间裂局限性增厚,少量积液可能。
【诊疗经过】
第一阶段:
第一阶段随访情况:
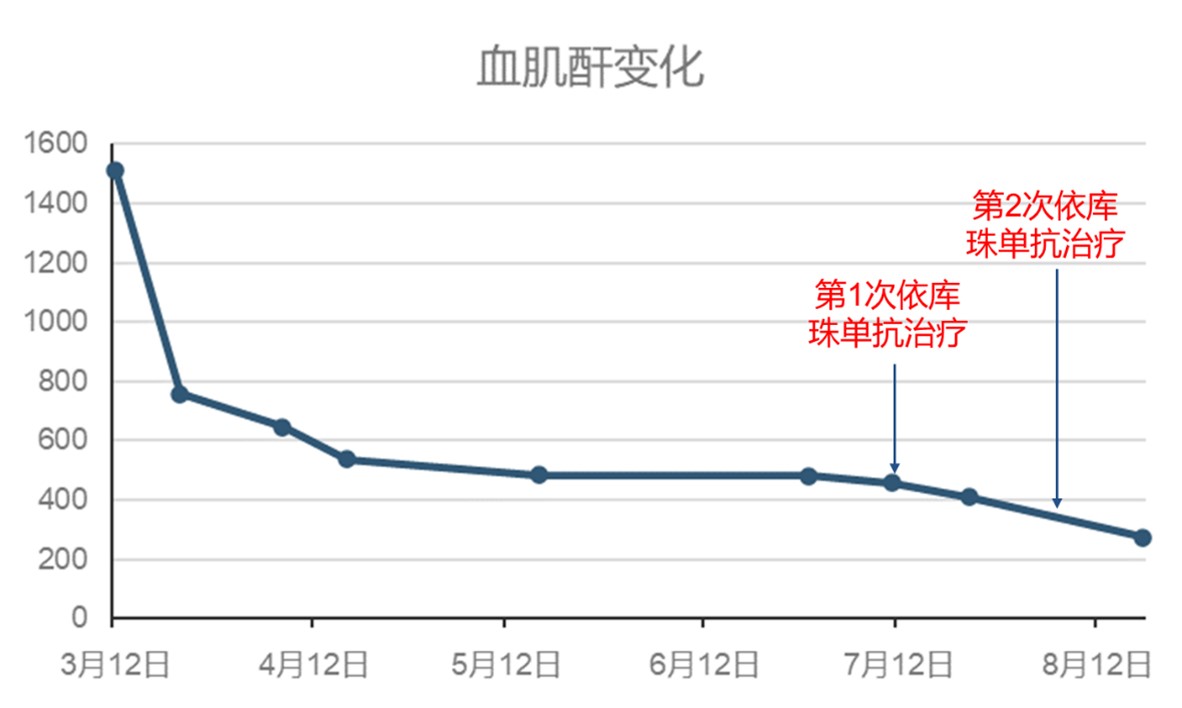
抗GBM:入院时>200RU/ml,3个月2.56 RU/ml;
血肌酐:入院时1509.3 umol/L,3个月后降为486.3umol/L,停止血液透析治疗;
每日尿量:入院时<1000ml,3月后恢复至2000ml左右。
第二阶段:
考虑患者肾功能恢复开始变缓慢,2024-6-29检查C5b-9(ELISA法):821ng/ml(参考区间75-219),于7-13及7-25分别给与依库珠单抗900mg治疗。
第二阶段随访情况:
血肌酐:依库珠单抗治疗前486.3umol/L,治疗后2周275.6umol/L;
血清C5b-9:治疗前821ng/ml,治疗后降至305mg/ml。
重复肾活检(2024-8-14)
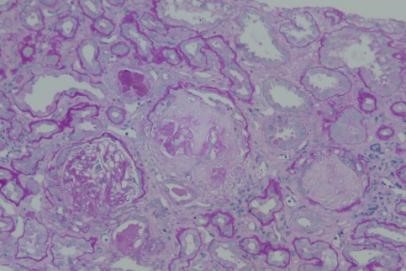
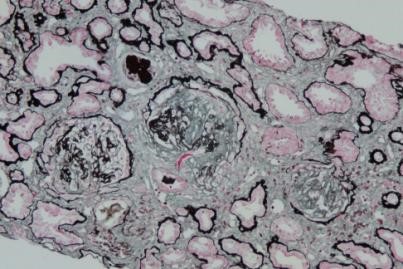
光镜: 22个肾小球。全片见15处全球硬化(68%,均伴有新月体形成痕迹),4处球囊粘连(18%),其中3处伴节段硬化(14%),1处纤维细胞性新月体(5%),以上病变累及20处肾小球(91%)。肾小球未见明显系膜细胞增殖及系膜基质增宽,内皮细胞未见明显增殖,毛细血管襟皱缩、开放不良,包曼氏囊壁壁层上皮细胞泡沫样改变。肾小管:见多灶性、中度萎缩,部分上皮细胞颗粒样变、泡沫细胞样变,再生及重排,部分肾小管轻度扩张,管腔内见少量蛋白管型。间质:见多灶性、轻度炎细胞浸润,炎细胞以淋巴做性拉细胞浸润,见多灶性、中度纤维化。
肾动脉壁:细动脉内可见血栓形成(a),管腔闭塞。
免疫荧光:1个肾小球:IgG(+),IgG1(+),IgG4(-)沿毛细血管袢线状沉积;Fib(+)沿毛细血管袢颗粒样沉积;IgA,IgM,C3,C4,C1q均阴性。


诊断:新月体性肾小球肾炎I型
肾小球缺血样改变
肾内动脉血栓性微血管病
【病例讨论】
该患者为青年男性,感染起病,临床表现为典型急进性肾炎综合征。肾脏病理提示:I型新月体性肾小球肾炎;急性肾小管-间质肾炎。抗GBM阳性。诊断较明确,为抗肾小球基底膜病。
抗肾小球基底膜(glomerular basement membrane, GBM)病是一种小血管炎,即循环抗体靶向攻击GBM和肺泡基底膜(alveolar basement membrane, ABM)的固有抗原,从而导致急进性肾小球肾炎和/或肺泡出血1。若未得到治疗,通常会迅速进展为终末期肾病(ESKD)。由于初始肾活检所示新月体百分比及治疗前血浆肌酐浓度与结局最为相关,早期诊断和干预对于获得最佳疗效至关重要。开始治疗时就需要透析的患者中,肾功能很少能恢复。
抗GBM的治疗:
血浆置换:
对于大多数抗GBM病患者,推荐血浆置换+免疫抑制的联合治疗,而非单用免疫抑制治疗(Grade 1C)。这包括所有肺出血(咯血)患者、无论肾脏是否受累和/或严重程度,以及所有无需立即透析的肾脏受累患者。需要立即透析、但没有肺出血的患者可考虑尝试性治疗,例如起病非常急、活检显示局灶性新月体形成和肾小管损伤、或存在抗中性粒细胞胞质抗体(ANCA)阳性伴系统性血管炎临床征象。
免疫抑制:
建议采用糖皮质激素+环磷酰胺联合疗法,而不是其他免疫抑制剂(Grade 2C)。常用方法每日给予甲泼尼龙冲击治疗、连用3日(15-30mg/kg,最大剂量1000mg),然后改为每日口服泼尼松[1mg/(kg·d),最大剂量60-80mg/d)],一旦诱导缓解可逐渐减量。环磷酰胺的初始剂量为口服2mg/(kg·d)。
补体抑制:
近年来,补体激活与肾脏疾病进展的关系越来越受到重视。在抗GBM肾病中,补体激活是重要的发病机制。与GBM结合的自身抗体通过激活补体系统引起损伤,导致C5a募集中性粒细胞和终末攻膜复合体损伤细胞1。尽管血浆中的C3和C4水平通常不会降低,但C1q和C4d在肾小球中沉积,这与经典途径的激活是一致的2。两项临床研究也表明补体因子C3有重要作用,其显示C3强染色和血清中C3水平轻微降低与预后较差相关3,4。补体抑制剂在抗GBM病的前临床模型中具有保护作用,表明补体在肾小球基膜上的激活会导致肾小球损伤5。目前的治疗主要集中在消除致病性B细胞和自身抗体,但即使在治疗后,许多患者仍会进展至肾功能衰竭。值得注意的是,即使血浆置换可以从循环中去除自身抗体,但已经与毛细血管壁结合的抗体可能仍会继续导致肾小球损伤6。因此,补体抑制药物在理论上可以在等待其他干预措施降低自身抗体水平的同时,预防肾小球损伤。一项病例报告指出,在两名对其他治疗(具体而言,糖皮质激素、环磷酰胺、利妥昔单抗和血浆置换)无反应的患者中,C5阻断具有保护作用,这支持了补体阻断在该疾病中的潜在作用7。
本例患者,我们初期给与了激素冲击+血浆置换+环磷酰胺治疗。从患者发病情况及病理情况判断,肾脏预后较差,早期血肌酐迅速下降考虑同患者合并肾小管-间质肾炎缓解有关。后期患者肾功能恢复速度缓慢,结合患者在治疗过程中有反复感染的情况,我们考虑患者是否存在补体持续激活情况,并进行了血清C5b-9的检查,发现循环终末攻膜复合体显著升高,因此给与了两次依库珠单抗治疗,并在两次治疗后进行了重复肾活检及血清C5b-9复查。虽然重复肾活检显示患者出现慢性化改变,全球硬化小球比例达到了68%,但补体沉积转阴。同时临床发现C5b-9浓度下降,且血肌酐较前进一步下降。提示尽管肾小球出现慢性化改变,但补体治疗依然能使患者获益。另外也提示我们如果更早开始补体抑制治疗,是否可以减少患者肾小球硬化的比例。
同时,我们还需要认识多补体抑制治疗的风险。补体抑制药物的主要风险可能是增加感染的易感性。补体阻断的总体风险取决于药物在级联反应中的作用部位、治疗持续时间以及可能使患者易于感染的其他临床特征。当补体抑制剂与其他免疫抑制药物联合使用时,感染的风险可能更大。值得注意的是,补体蛋白在自身免疫性疾病中经常被消耗,这已经增加了受影响患者的感染风险,并可能抵消补体抑制剂的附加风险。这些考虑还必须与基础疾病的总体预后和其他治疗方法的可用性进行权衡。接种疫苗和使用预防性抗生素可能对降低感染风险至关重要。因此,补体抑制治疗级联部位的选择以及介入的时机,仍然需要今后大量临床研究的进一步明确。
【参考文献】
1. Tang A,et al. Front Immunol. 2023;14:1229806. Epub 2023 Sep 15.
2. Ma, R. et al. The alternative pathway of complement activation may be involved in the renal damage of human anti-glomerular basement membrane disease. PLoS One 9, e91250 (2014).
3. Caillard P, et al. Prognostic value of complement serum C3 level and glomerular C3 deposits in anti-glomerular basement membrane disease. Front Immunol. 2023;14:1190394. Epub 2023 Jul 5.
4. Zhu M, et al. Relationship Between Serum Complement C3 Levels and Outcomes Among Patients With Anti-GBM Disease. Front Immunol. 2022;13:929155. Epub 2022 Jul 8.
5. Quigg, R. J. et al. Blockade of antibody-induced glomerulonephritis with Crry-Ig, a soluble murine complement inhibitor. J. Immunol. 160, 4553–4560 (1998).
6. Van Daalen, E. E. et al. Predicting outcome in patients with anti-GBM glomerulonephritis. Clin. J. Am. Soc. Nephrol. 13, 63–72 (2018).
7. Nithagon, P. et al. Eculizumab and complement activation in anti-glomerular basement membrane disease. Kidney Int. Rep. 6, 2713–2717 (2021).