血管炎还是igg4相关性疾病?
天津医科大学总医院 徐鹏程
【病例摘要】:
一位男性57岁患者,主诉“纳差、乏力伴泡沫尿3月余”入院。患者于3月余前无明显诱因出现纳差、乏力,在正常饮食下患者体重减轻7kg,乏力表现为四肢无力,以双下肢为著,步行100米后即自感双下肢酸痛,病程中偶有轻微吞咽困难、厌油腻饮食,患者至我院门诊检查示:血常规:白细胞计数9.58*109/L↑,血红蛋白113g/L↓,血小板计数317*109/L;游离甲功:三碘甲状腺原氨酸0.90nmol/L↓,余未见异常;免疫全项示:免疫球蛋白G2430.00mg/dl↑,C-反应蛋白13.30mg/dl↑;肝肾功能:乳酸脱氢酶83.0U/L↓,谷氨酰转酞酶50U/L↑,球蛋白51g/L↑,白蛋白28g/L↓,肌酐142μmol/L↑,β2微球蛋白8.96mg/L↑;肿瘤全项未见异常。腹部超声示:双肾正常大小,表面光滑,实质回声均匀,胆囊壁欠光滑;脾脏形态稍饱满;肝门胰头区淋巴结肿大;左肾囊肿;右肾未见明显异常。上腹部MR平扫示:胰尾信号异常,随诊复查;肝内小囊肿;脾大;胃充盈不佳,壁显厚;肝门周围、腹主动脉旁多发淋巴结,部分形态饱满,请结合临床。门诊予康复新液、胰酶片等对症治疗,症状未见缓解,患者后收入我院消化科继续治疗,完善相关化验检查:肝功能:球蛋白50g/L↑,白蛋白26g/L↓。肾功能示:尿素11.0mmol/L↑,肌酐195μmol/L↑。尿常规:尿潜血1+↑,尿白蛋白1+↑。24h尿蛋白858.0mg↑。凝血功能:血浆D-二聚体1708ng/ml↑。肿瘤全项:胃泌素释放肽前体64.66pg/ml↑。血三项示:铁蛋白1094.26ng/mL↑,叶酸2.54ng/mL↓,B12未见异常。促红细胞生成素4.82mIU/ml↓。ANCA-P型-IIF阳性↑,抗MPO-ELISA220.26RU/ml↑。免疫固定电泳正常。尿NGAL120.84ng/ml↑,血IgG4:24.8g/L(0.03-2.01)。患者行PET-CT,报告示:1.双肾实质代谢水平弥漫增高,考虑双肾炎性病变可能性大。2.双肺背侧胸膜下区多发蜂窝影,代谢不均匀增高,考虑为双肺间质炎症、间质纤维化。3.胸部多发饱满淋巴结影,代谢对称性增高,考虑为淋巴结反应性增生。4.右侧肩关节周围软组织代谢不均匀增高,考虑为关节周围软组织炎性病变。入消化科后予抑酸、补液、补蛋白、补充叶酸、B12等对症治疗,结合病史,考虑IgG4相关性疾病合并ANCA相关性血管炎不除外,现为求进一步诊治收入我科。患者自本次发病以来,精神尚可,食欲减退,睡眠尚可,大便次数增多,4-5次/天,小便如常,体重下降7kg。既往平素健康状况良好,无高血压、糖尿病、冠心病病史;否认传染病史;预防接种史按规定;无外伤史;否认输血史;否认药物食物过敏史。出生于天津市,久居于当地居住地。有吸烟史40年,平均20支/日;有饮酒史40年,平均150ml/日。否认疫水疫区接触史。无工业毒物、粉尘、放射性物质接触史。无冶游史。无新冠肺炎流行病学接触史。无近期高风险地区旅居史。已婚,配偶健康状况良好,育有1女。否认家族遗传性病史。
【诊疗经过】:
入院查体:体温 36.5℃ 脉搏 112次/分 呼吸 17次/分 血压 110/70mmHg,体重 49.0kg 身高 170cm,神志清醒,发育正常,营养不良,自主体位,对答切题,查体合作。皮肤粘膜无黄染。全身浅表淋巴结无肿大。颈软,颈静脉无怒张,双侧甲状腺无肿大。双肺呼吸音清,未及干湿啰音。心率112次/分,心律齐,无病理性杂音。腹壁柔软,无压痛,无反跳痛,肝肋下未触及,脾肋下未触及,未触及腹部包块。无肝区叩击痛,无肾区叩击痛,移动性浊音(-)。四肢活动自如,双下肢无浮肿。生理反射存在,病理反射未引出。
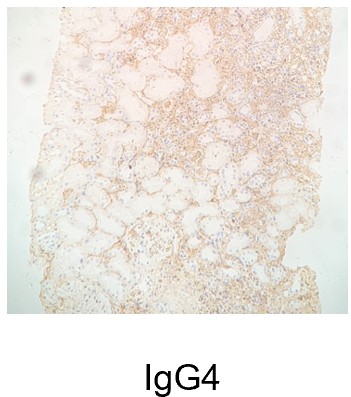
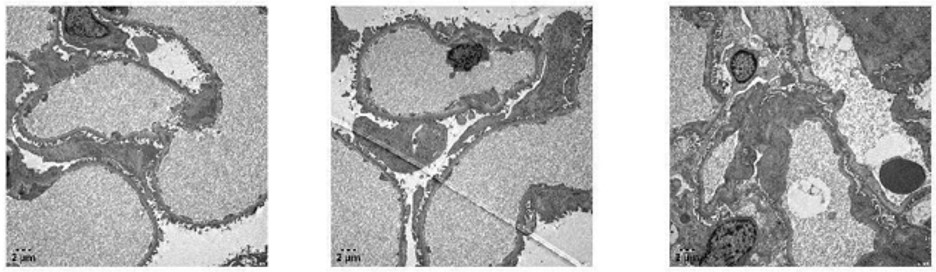
患者入院后行肾活检,光镜检查:肾穿刺组织可见29个肾小球,4个球性硬化,1个缺血性硬化,其余肾小球系膜细胞及基质轻度局灶节段性增生,其中1个纤维素样坏死伴大型细胞性新月体,2个大型细胞纤维性新月体,5个大型纤维性新月体形成。肾小管上皮细胞空泡颗粒变性,多灶状萎缩,小灶状刷状缘脱落、细胞扁平、管腔扩张。肾间质多灶状浆细胞及淋巴、单核细胞浸润伴有纤维化。小动脉管壁增厚。免疫组织化学:间质可见散在CD44+,CD68+,CD3+细胞,可见多处CD138+细胞;偶见少量散在IgG1+,IgG2+,IgG3+细胞,可见多处IgG4+细胞。免疫荧光:可见4个肾小球。C3+++、IgM +沿节段肾小动脉管壁团块状沉积,IgA、IgG、 C1q、C4、FRA、Alb为阴性。κ链:未见特异性沉积;λ链:未见特异性沉积。PLA2R(—), THSD7A(—),NELL-1(—)。IgG亚型:IgG1(—),IgG2(—),IgG3(—),IgG4(—)。HBsAg (—),HBcAg (—)。电镜检查:基底膜无明显增厚,足突阶段性融合,未见确切电子致密物沉积。
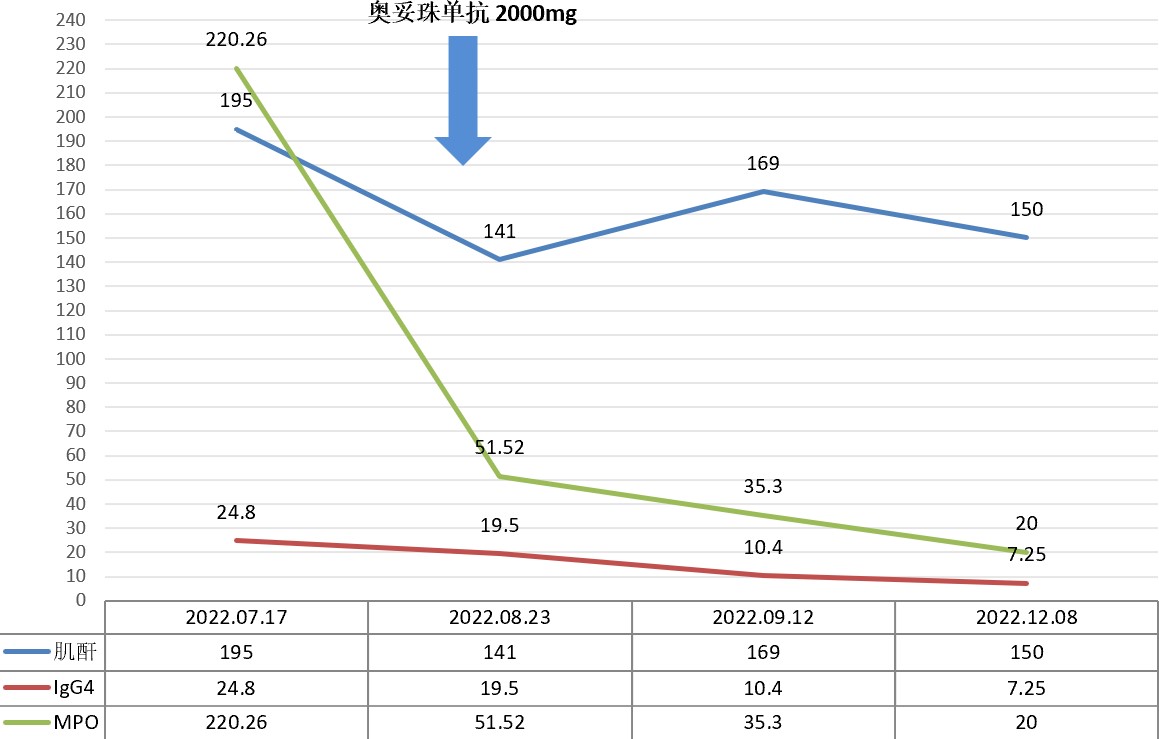
最终病理诊断:符合:1局灶增生坏死型肾小球肾炎伴部分新月体形成,结合临床,符合ANCA相关性系统性血管炎;2亚急性间质小管肾病,考虑IGG4相关性肾间质小管肾病。患者接受奥妥珠单抗治疗,随诊恢复良好:
【病例讨论】:
IgG4相关性疾病会累及全身各个器官,其诊断标准如下:1、血清中IgG4浓度大于135mg/dL。2、临床检查显示一个或者多个器官表现出局限性或者弥漫性肿胀或肿块。3、受累组织浸润的IgG4+/IgG+浆细胞比例高于40%,并且在每高倍镜视野下IgG4+浆细胞大于10个。尽管血清 IgG4 水平升高是 IgG4‑RD 的特征之一,来自多个国家的研究表明血清IgG4水平升高在IgG4‑RD的诊断中缺乏特异性,血清 IgG4 水平升高可见于多种疾病,如AAV、多中心型 Castleman 病、重症哮喘及类风湿性关节炎等,其中AAV患者血清IgG4水平升高尤为明显。2010年日本 学 者 Yamamoto 等首 先 观 察 了 5 例 CSS 患 者(MPO‑ANCA 均为阳性)的血清 IgG4 水平,结果显示 CSS 患者血清 IgG4 显著升高,平均水平为(4.46±3.63)g/L,IgG4占总IgG百分比为(20.15±9.55)%。该研究团队的另一项研究表明,80% 的 CSS 患者血清 IgG4 水平超过 144 mg/dl[1]。
AAV确实可以伴发类似于IgG4-RD的病变。一项来自欧洲的多中心研究纳入了更多 AAV患者,进一步研究了 IgG4 免疫反应状况,该研究结果不但表明CSS 和GPA患者血清 IgG4水平显著高于健康对照,而且进一步相关性分析结果表明,活动性 CSS 患者血清IgG4 水平与受累器官数目及伯明翰系统性血管炎活动评分(Birmingham vasculitis activity score,BVAS)显著相关,并对部分活动性CSS 患者进行了随访,发现治疗后病情缓解伴随血 IgG4 水平以及 IgG4/IgG 百分比均显著下降[2]。2011 年 Raissian 等在研究和验证IgG4‑TIN 诊断标准时发现 41 例寡免疫复合物肾小球肾炎中13例呈现中度(11~30 个细胞/高倍视野)到重度(>30 个细胞/高倍视野)IgG4+浆细胞浸润。在诊断IgG4‑TIN时需要剔除寡免疫复合物肾小球肾炎病例,肾活检组织IgG4+浆细胞 >10个/高倍视野这一标准方能显示较高的敏感性(100%)和特异性(92%)[3]。北大医院的一项纳入26例确诊的 GPA 患者的研究表明,当采用了严格的 IgG4+和 IgG+浆细胞计数方法,进一步研究 IgG4+浆细胞在 GPA 组织中浸润情况时。发现26个活检标本中8 例来源于鼻窦和眼眶/眶周的标本显示 IgG4+浆细胞浸润明显增加(IgG4+浆细胞>30 个/高倍视野,IgG4+/IgG+浆细胞>40%)[4]。
另一方面,诊断为IgG4‑RD患者也可伴ANCA阳性。2015年Kronbichler等首先报道了1例确诊为IgG4‑TIN患者,伴随高滴度血清PR3‑ANCA,但是未发现AAV的其他临床和病理证据[5]。2012年 Ayuzawa 等首先报道了1例68岁女性患者,哮喘、肾功能不全、右正中神经麻痹,皮疹活检提示白细胞碎裂性血管炎,符合典型的 CSS;该患者同时伴有唾液腺肿大、血清IgG4水平升高(275 mg/dl),肾脏活检病理表现为嗜酸细胞及显著 IgG4+浆细胞浸润性 TIN,缺乏血管炎病理特征,提示 CSS 同时合并了肾脏受累为主的IgG4‑RD[6]
AAV 和 IgG4‑RD 重叠在同一器官的报道主要见于肾脏。Sakairi 等报道了 1 例患者 IgG4‑RD 和 ANCA 阴性AAV同时累及肾脏,该患者肾功能进行性恶化,肾脏活检病理表现为IgG4‑TIN和新月体型肾小球肾炎及坏死性小动脉炎重叠[7]。Su 等报道了1例患者血IgG4水平升高 、MPO‑ANCA阳性、肾脏活检病理提示坏死性新月体肾炎和典型的IgG4‑TIN重叠,对ANCA的IgG亚型进一步分析显示该患者 MPO‑ANCA 主要属于 IgG4 亚型(77.3%),其余为IgG1亚型(22.7%),没有检测到 IgG2和IgG3 亚型,推测AAV可能和IgG4‑RD存在相似的发病机制[8]。尽管AAV和IgG4‑RD均为系统性疾病,但是二者重叠发生于肾脏的病例报道主要以肾功能受损为突出,其他器官受累较少或程度较轻。
AAV 患者伴血清 IgG4 水平升高时,需要评估是否重叠IgG4‑RD,尤其需要注意排除存在IgG4‑RD脑膜、眼部等潜在致命性器官受累的可能。当患者临床呈现AAV特征,血清IgG4水平升高和肾脏病理提示IgG4‑TIN时,需要仔细检查肾脏病理,避免漏掉可能合并的 AAV,从而延误治疗。当确诊的IgG4‑RD患者伴MPO‑或PR3‑ANCA阳性时,需要进一步检查和密切随访,警惕合并 AAV 或后续 AAV 发生的可能,避免延误 AAV 的诊断和治疗。多数IgG4‑RD 患者对糖皮质激素反应良好,少数糖皮质激素治疗无效的患者可以联合免疫抑制剂,近年研究显示利妥昔单抗对激素抵抗的IgG4‑RD患者有效。AAV的治疗以糖皮质激素联合免疫抑制剂为主,也可选择利妥昔单抗治疗。
【参考文献】
[1] Yamamoto M, Tabeya T, Naishiro Y, Yajima H, Ishigami K, Shimizu Y, Obara M, Suzuki C, Yamashita K, Yamamoto H, Hayashi T, Sasaki S, Sugaya T, Ishida T, Takano K, Himi T, Suzuki Y, Nishimoto N, Honda S, Takahashi H, Imai K, Shinomura Y. Value of serum IgG4 in the diagnosis of IgG4-related disease and in differentiation from rheumatic diseases and other diseases. Mod Rheumatol. 2012 Jun;22(3):419-25. doi: 10.1007/s10165-011-0532-6. Epub 2011 Sep 28. PMID: 21953287.
[2] Vaglio A, Strehl JD, Manger B, Maritati F, Alberici F, Beyer C, Rech J, Sinico RA, Bonatti F, Battistelli L, Distler JH, Schett G, Zwerina J. IgG4 immune response in Churg-Strauss syndrome. Ann Rheum Dis. 2012 Mar;71(3):390-3. doi: 10.1136/ard.2011.155382. Epub 2011 Nov 25. PMID: 22121132.
[3] Raissian Y, Nasr SH, Larsen CP, Colvin RB, Smyrk TC, Takahashi N, Bhalodia A, Sohani AR, Zhang L, Chari S, Sethi S, Fidler ME, Cornell LD. Diagnosis of IgG4-related tubulointerstitial nephritis. J Am Soc Nephrol. 2011 Jul;22(7):1343-52. doi: 10.1681/ASN.2011010062. Epub 2011 Jun 30. PMID: 21719792; PMCID: PMC3137582.
[4] Chang SY, Keogh K, Lewis JE, Ryu JH, Yi ES. Increased IgG4-Positive Plasma Cells in Granulomatosis with Polyangiitis: A Diagnostic Pitfall of IgG4-Related Disease. Int J Rheumatol. 2012;2012:121702. doi: 10.1155/2012/121702. Epub 2012 Apr 11. PMID: 22577389; PMCID: PMC3332209.
[5] Kronbichler A, Gut N, Zwerina J, Neuwirt H, Rudnicki M, Mayer G. Extending the spectrum of a chameleon: IgG4-related disease appearing as interstitial nephritis and mimicking anti-neutrophil cytoplasmic antibody-associated vasculitis. Rheumatology (Oxford). 2015 Oct;54(10):1936-8. doi: 10.1093/rheumatology/kev248. Epub 2015 Jul 9. PMID: 26163289.
[6] Ayuzawa N, Ubara Y, Keiichi S, Masayuki Y, Hasegawa E, Hiramatsu E, Hayami N, Suwabe T, Hoshino J, Sawa N, Kawabata M, Ohashi K, Takaichi K. Churg-Strauss syndrome with a clinical condition similar to IgG4-related kidney disease: a case report. Intern Med. 2012;51(10):1233-8. doi: 10.2169/internalmedicine.51.6074. Epub 2012 May 15. PMID: 22687796.
[7] Sakairi T, Okabe S, Hiromura K, Motegi S, Sakurai N, Ikeuchi H, Kaneko Y, Maeshima A, Hirato J, Nojima Y. A case of ANCA-negative renal small-vessel vasculitis with tubulointerstitial infiltration of IgG4-positive plasma cells. Mod Rheumatol. 2016 Sep;26(5):780-3. doi: 10.3109/14397595.2014.915510. Epub 2014 May 20. PMID: 24842479.
[8] Su T, Yang L, Cui Z, Wang SX, Zhao MH. Concurrent IgG4-related tubulointerstitial nephritis and IgG4 myeloperoxidase-anti-neutrophil cytoplasmic antibody positive crescentic glomerulonephritis: A case report. Medicine (Baltimore). 2017 May;96(20):e6707. doi: 10.1097/MD.0000000000006707. PMID: 28514287; PMCID: PMC5440124.