一例母系遗传性糖尿病和耳聋引起的继发性局灶节段性肾小球硬化症
病历资料
患者,女性,26岁
主诉:口渴多饮6月,尿检异常1月余
现病史:6月前出现口渴多饮;1月前住我院内分泌科,测血糖25.37mmol/,诊断“糖尿病”,尿蛋白2+,白蛋白34.4g/L,24H尿蛋白0.99g/24H,予以胰岛素静脉泵降糖,后更改为甘精胰岛素+门冬胰岛素降糖,血糖控制平稳后出院。门诊复查尿蛋白3+,尿微量白蛋白1738.91mg/L,遂收住我科,病程中,患者神清,精神可,无咳嗽咳痰,无恶心呕吐,饮食睡眠可,大便正常,无尿频尿急尿痛,尿液泡沫较多,近期体重增加约2kg。
既往史及家族史:10年前高考体检发现双耳听力欠佳,1年前行听力测试示双侧神经性耳聋;2年前因“上睑下垂”行重睑术。母亲患糖尿病,已去世。
体格检查:T36℃,P82次/分,R16次/分,BP110/72mmHg;身高158cm,体重41.5kg,BMI 16.65kg/m2,多毛。神清,精神可,全身皮肤黏膜未见黄染,浅表淋巴结未及肿大,心肺(-),腹软,无压痛及反跳痛,肝脾肋下未及,双肾叩击痛(-),双下肢无明显水肿,四肢肌力肌张力正常,巴氏征(-)。
辅助检查:胸片:两肺未见明显实质性病变。心电图:1.窦性心律,2.正常心电图。心脏彩超:正常范围多普勒心动图(LA 2.72cm,LVD 4.51cm,EF 64%)。泌尿系+肾血管彩超:双肾轻度弥漫性病变(右肾大小:104*36mm,皮质厚:6mm;左肾大小:101*35mm,皮质厚:6mm)。甲状腺彩超:双侧甲状腺弥漫性病变。眼底检查:双眼角膜透明,瞳孔对光反射正常,晶体透明,眼底未见明显出血、渗出。
实验室检查:血常规:WBC:6.0x10^9/l、HGB:126g/l;肝肾功能、电解质:ALB:40.0g/l;Cr:70.8umol/l;UA:417μmol/L;eGFR:107ml/(min.1.73m2);电解质无异常;PLT: 246x10^9/l;甲功三项及抗体:T3 1.34nmol/L、T4 66.80nmol/L、TSH 0.354uIU/ml; 甲状腺球蛋白抗体342.3U/ml甲状腺过氧化酶抗体42.90U/ml.尿蛋白十一项:转铁蛋白:22.83mg/L、尿微量白蛋白 452.68mg/L、IgG: 27.77mg/L、胱抑素C<0.05mg/L、肌酐:2.52mmol/L、β2-MG:0.04mg/L;尿ACR:1592.12mg/gcr;24h尿蛋白:1.40g。性激素6项、免疫十一项、ANA、ANCA全套、ACL、免疫球蛋白+补体、血清免疫固定电泳、血尿轻链、IgG4等未见异常。
病情梳理(一):青年女性,肾脏表现:肾小球源性蛋白尿-肾小球疾病;糖尿病病史较短,未分型,有糖尿病家族史,神经性耳聋,身材矮小,多毛,桥本甲状腺炎。鉴别诊断:1)遗传性肾炎:Alport综合征、薄基底膜肾病,指甲-髌骨综合征;2)继发性:免疫介导、感染继发肾病,糖尿病肾病;3)原发性:IgA肾病、FSGS、MN,MPGN。结合该患者青年起病、体型偏瘦、胰岛素抗体阴性、胰岛功能较差、有母系糖尿病家族史伴有神经性耳聋,需警惕特殊类型糖尿病。
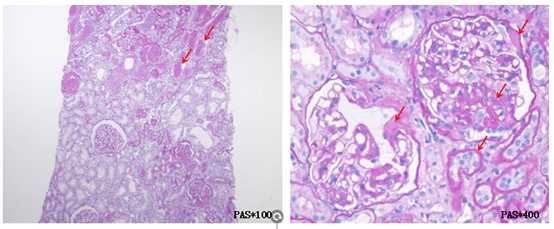
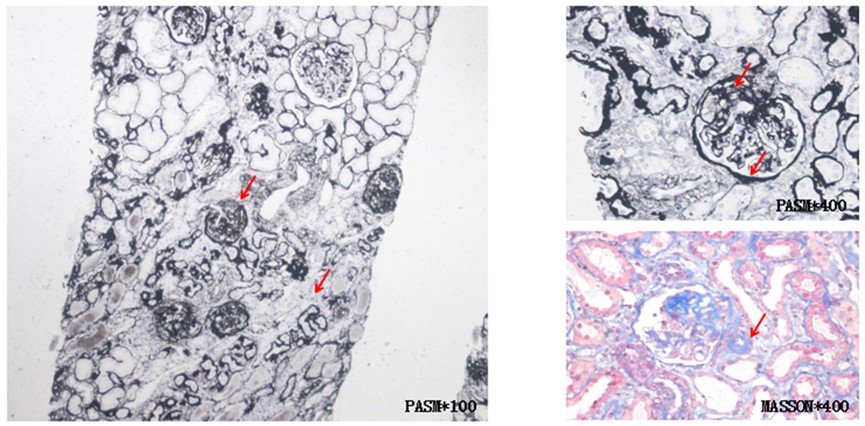
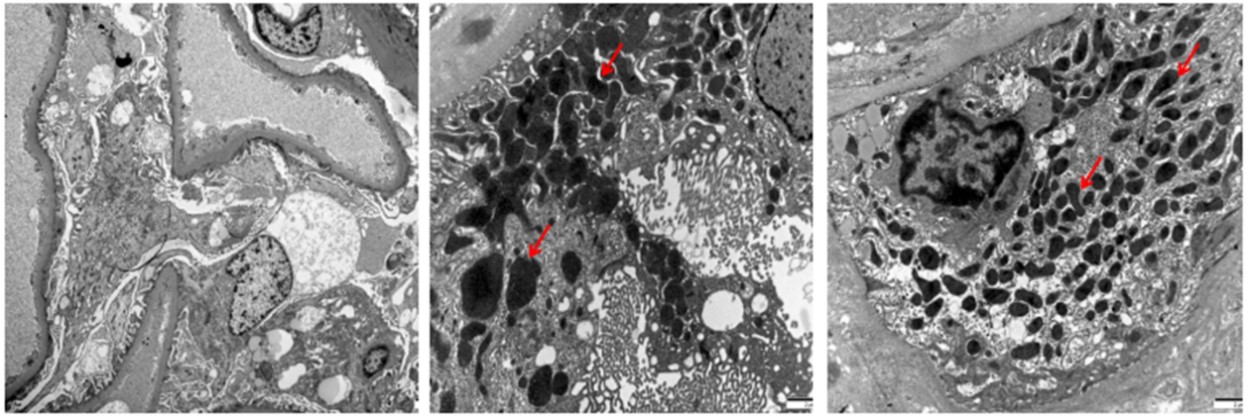
肾脏病理显示:光镜28个肾小球,其中15个呈缺血性硬化伴肾小管多灶性萎缩,2个肾小球呈节段性硬化伴玻璃滴样病变。其余肾小球可见系膜基质轻度增多所致的系膜区轻度增宽(图1)。此外,可见局灶性肾小管萎缩和间质纤维化。间质炎性浸润通常极少。免疫荧光显示肾小球基底膜或系膜区有IgG沉积,而无IgA、IgM、C3、C1q、Kappa和Lambda沉积(图2)。电镜:肾小球基底膜增厚波动于290-350nm,系膜细胞及基质轻度增生,足突融合40%,可见肾小管上皮细胞胞质内大量变性肿胀及异型性线粒体(图3),肾间质淋巴单核细胞浸润伴胶原纤维形成。 病理诊断:1.局灶节段肾小球硬化症,继发于线粒体性糖尿病。2.糖尿病小血管病变。3.肾脏损伤类型及特征:肾小球轻度增生,缺血性硬化肾小球(12/28),局灶节段门部型硬化肾小球(1/28),局灶节段非特殊型硬化肾小球(1/28),中度肾小管萎缩/间质纤维化(30%),小动脉管壁明显增厚,出入球小动脉均质玻璃样变。4.肾活检组织慢性病变程度评分:GS:2,IF:2,TA:2,CV:1,中度慢性。
a
b
图1.光镜检查。可见缺血性硬化伴肾小管多灶性萎缩,节段性硬化伴玻璃滴样病变及间质纤维化。
图2. 肾小球免疫荧光
图3.肾组织电镜分析(×4000)。可见足突节段性融合及形态异常的线粒体。可见系膜基质轻度增多,但肾小球基底膜未见明显改变。
基因检测:基于糖尿病、耳聋、继发性FSGS以及患者糖尿病家族史,考虑母系遗传性糖尿病和耳聋的诊断。为此安排了分子遗传学分析。为明确诊断,采集患者血液提取线粒体DNA并进行全mtDNA测序分析。结果显示线粒体DNA存在3243位点(A3243G)的点突变,突变率为43.64%,证实了MIDD的诊断。除胰岛素和缬沙坦外,每日给予患者辅酶Q10 150 mg。3个月后,尿蛋白明显减少至每日0.5 g。每日尿蛋白<0.5 g的状态持续近1年。安排更长期的随访。
病例讨论:
母系遗传性糖尿病和耳聋(MIDD)约占糖尿病患者总数的1% [1]。常见的临床表现包括糖尿病、耳聋、消瘦和母系遗传特征。其他常见异常还包括心脏病、肾脏病、眼科疾病、胃肠道疾病、肌病和身材矮小[2],常被误诊为单纯的1型或2型糖尿病。及时诊断有助于制定正确的治疗方案。本文报告一例由MIDD引起的继发性局灶节段性肾小球硬化症。在本病例中,患者首先被诊断为糖尿病和耳聋。蛋白尿与短期糖尿病病史之间的不平衡性令我们困惑。肾活检未显示典型的糖尿病肾病特征,而是提示FSGS。Hildebrandt及其同事建议,对有FSGS患儿的每个家庭都应提供进行基因诊断的机会[3]。基于糖尿病、耳聋、继发性FSGS及其糖尿病家族史,考虑了MIDD。患者全mtDNA测序分析显示线粒体DNA存在3243位点(A3243G)的点突变。线粒体基因tRNA Leu (UUR) A3243G突变占所有致病突变的85%。若能展示患者家族成员的病史和mtDNA分析结果,诊断将更完整。
首例MIDD综合征由Reardon W等人于1992年报告[4]。MIDD患者发生终末期肾病的比例很高。肾活检最常见的发现是FSGS[5]。蛋白尿、囊性肾病和肾小管间质肾病也是其他表现[6]。甚至有些MIDD中伴耳聋的肾脏病病例曾被误诊为Alport综合征[7]。MIDD常被临床医生误诊。线粒体DNA的遗传异常导致氧化产能缺陷[8]。肾脏病可能先于糖尿病或耳聋的诊断出现,甚至可能是m.3243A-G突变的唯一表现。MIDD中m.3243A-G的其他表现包括:中枢神经和精神系统特征、眼科疾病、肌病、心脏疾病、肾脏病、内分泌疾病、胃肠道疾病及其他杂项特征[9]。尽管罕见,及时正确诊断MIDD非常重要,因为它可能影响治疗策略。辅酶Q10作为线粒体呼吸链的电子载体,可改善突变相关的线粒体呼吸链功能障碍[10]。长期辅酶Q10治疗可预防MIDD患者进行性胰岛素分泌缺陷、运动不耐受和听力损失。在本病例中,已尝试辅酶Q10治疗,应安排更长期的随访。
总之,对于有肾脏病临床表现(尤其是蛋白尿)的患者,若在病程中还出现耳聋和糖尿病,应鉴别MIDD。及时诊断可以避免无效且不必要的免疫抑制治疗。长期辅酶Q10治疗可能对MIDD患者有益。
参考文献:
1. J.A. Maassen, L.M. T Hart, E. Van Essen, et al., Mitochondrial diabetes: molecular mechanisms and clinical presentation, Diabetes 53 (2004) 103e109.
2. Robinson KN, Terrazas S, Giordano-Mooga S, Xavier NA. The role of heteroplasmy in the diagnosis and management of maternally inherited diabetes and deafness Endocr Pract. 2020;26(2):241-246.
3. Reardon W, Ross RJ, Sweeney MG, et al. Diabetes mellitus associated with a pathogenic point mutation in mitochondrial DNA. Lancet. 1992; 340:1376-9.
4. Cui H, Kong Y, Zhang H. Oxidative stress, mitochondrial dysfunction, and aging. J Signal Transduct. 2012; 2012:646354.
5. Luo S, Valencia CA, Zhang J, et al. Biparental Inheritance of Mitochondrial DNA in Humans. Proc Natl Acad Sci U S A. 2018; 115:13039-13044.
6. Geng X, Zhang Y, Yan J, et al. Mitochondrial DNA mutation m.3243A>G is associated with altered mitochondrial function in peripheral blood mononuclear cells, with heteroplasmy levels and with clinical phenotypes. Diabet Med. 2019; 36:776-783.
7. Cao XY, Wei RB, Wang YD, et al. Focal segmental glomerulosclerosis associated with maternally inherited diabetes and deafness: clinical pathological analysis. Indian J Pathol Microbiol. 2013; 56:272-275.
8. Godinho I, Gameiro J, Jorge S, et al. Diabetes, deafness and renal disease. Clin Kidney J.2017; 10:487-489.
9. Guery B, Choukroun G, Noel L, et al. The spectrum of systemic involvement in adults presenting with renal lesion and mitochondrial tRNA (Leu) gene mutation. J Am Soc Nephrol 2003; 14: 2099–2108.
10. Bergamin CS, Rolim LC, Dib SA, Moisés RS. Unusual occurrence of intestinal pseudo obstruction in a patient with maternally inherited diabetes and deafness (MIDD) and favorable outcome with coenzyme Q10. Arq Bras Endocrinol Metabol. 2008;52(8):1345-1349.