肾脏与“结核君”的意外“碰面” ——急性血行播散性肺结核合并igg4相关性肾病1例
周芳芳1 张叶娜2 罗群1
1. 宁波市第二医院肾内科
2. 宁波市第二医院肺科
[病历摘要]
患者男性,56岁,汉族,主诉“咳嗽2月,抗痨后纳差1月余,少尿1天“于2024-3-30入院。
现病史:
患者2个月前无明显诱因下出现咳嗽咳痰,痰白色,每日10多口,间歇发热,体温高时达39.2℃,一般为38-39℃,夜间多发,伴头痛头晕畏寒寒战,偶有尿痛,无流涕,无盗汗,无咯血,无胸闷胸痛气促,同时发现有双侧颈部包块,无明显破溃流脓疼痛。于当地医院住院治疗并予颈部淋巴结穿刺,诊断为“继发性肺结核 颈部淋巴结结核”,予HREZ方案抗痨治疗 [异烟肼(H)0.1g,每日一次;利福平(R)0.15g,每日一次;乙胺丁醇(E)0.25g,每日一次;吡嗪酰胺(Z)0.25g,每日三次]。
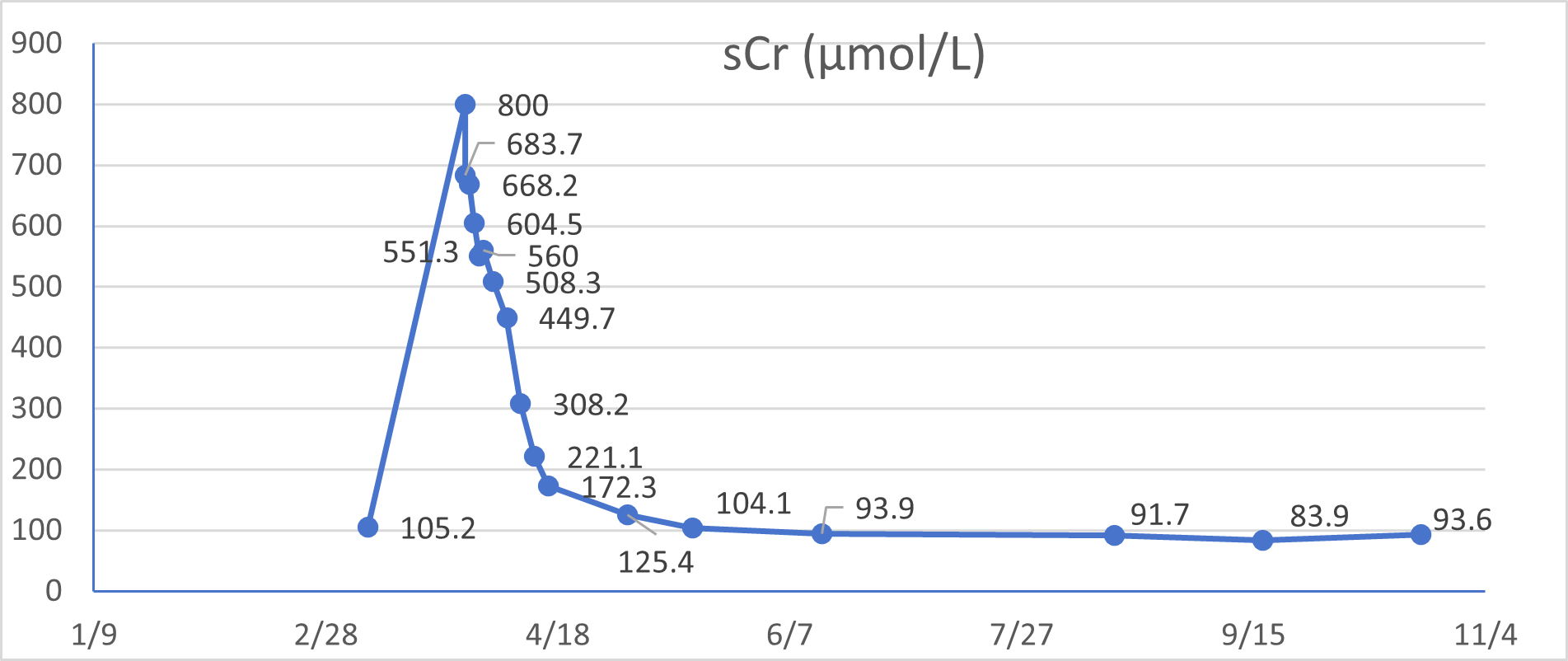
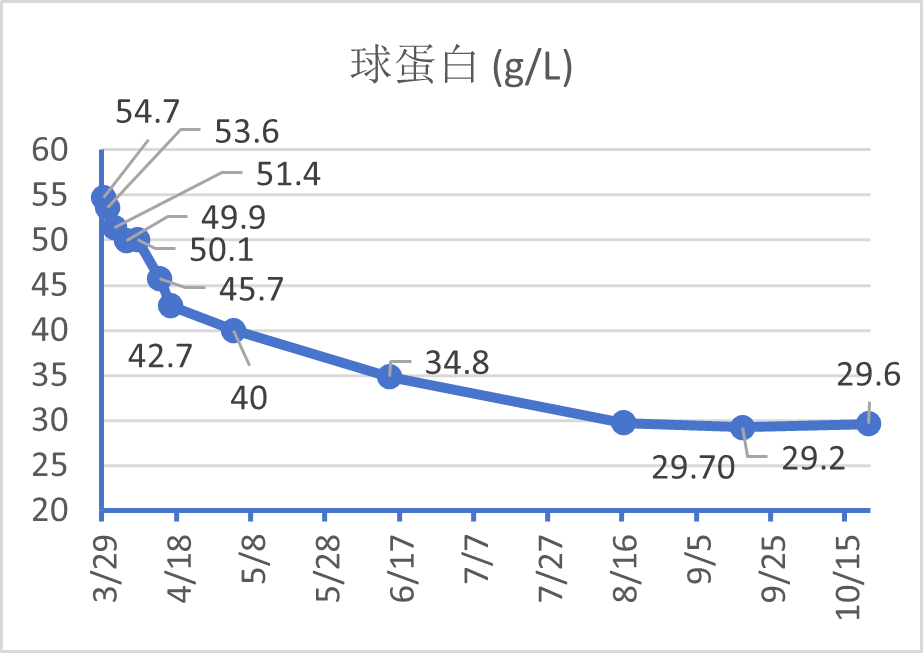
治疗约1个月后,患者咳嗽、发热症状缓解,但出现纳差,饭量减半,偶有恶心,无腹痛呕吐,半月前纳差加重,伴胃部不适。考虑到药物的肝、肾毒性副作用,抗结核方案调整为“异烟肼0.3g,每日一次;利福喷丁0.45g,每72小时一次;乙胺丁醇0.75g,隔日一次;莫西沙星0.4g,每日一次”。1天前患者出现少尿,无明显尿痛,无腹痛呕吐等不适,余症同前,来我院急诊科。查急诊生化提示急性肾损伤(“血肌酐(sCr):800μmol/L”,3月8日“sCr 105μmol/L”);高球蛋白血症(54.7g/L)、低钾血症(3.02mmol/L),以及贫血(83g/L)伴血小板减少(82×10⁹/L)。胸+腹部CT显示“双肺弥漫性粟粒样病变、右肺上叶陈旧性病变、纵隔淋巴结钙化,双肾增大”。予“氨溴索,多索茶碱,泮托拉唑”等对症处理,因有肺结核病史,收入肺结核科进一步诊治。
患者病来,神志清,精神一般,纳差,睡眠欠佳,尿量减少,尿色正常,大便无殊,体重无明显增减。
既往史:无殊
个人史、家族史:无殊
体格检查:
体温36.7℃,脉搏109次/分,呼吸19次/分,血压147/93mmHg ,体位自主体位,病容无病容,体重49kg,身高1.67m,BMI指数17.56KG/㎡,查体合作 ,双侧颈部各可及2-3个淋巴结肿大融合成包块,大者约0.5*1厘米、质地中、活动度中、有痛压,全身余部位浅表淋巴结未及肿大,颌下腺未及肿大,呼吸运动两侧对称,叩诊清音,呼吸音正常,未闻及干湿性啰音,无胸膜摩擦音,心率109次/分,心律齐,心音正常,杂音未闻及病理性杂音,腹平坦,蠕动波未见,腹壁紧张度柔软,压痛无,反跳痛无,包块未及,肝脏肋下未触及,胆囊未触及,莫菲氏征阴性,脾脏肋下未触及,肾区无叩击痛,肠鸣音4次/分,移动性浊音阴性,双下肢无水肿。
【入院后相关化验检查】
入院后化验:
血常规
白细胞(*10^9/L)
中性粒细胞(%)
血红蛋白(g/L)
血小板(*10^9/L)
5.8
84.20
76
87
体液免疫功能
IgG
(g/L)
IgM
(g/L)
IgA
(g/L)
补体 C1q
(mg/L)
补体 C3
(mg/L)
补体C4
(mg/L)
IgG4
(g/L)
32.82
2.34
4.06
455.56
0.93
0.20
3.51
尿蛋白
尿总蛋白/肌酐比值 (mg/g)
尿白蛋白/肌酐比值 (mg/g)
24小时尿总蛋白 (mg)
24小时尿微量白蛋白 (mg)
提示尿蛋白以非白蛋白为主
2549.8
174.2
1938.8
101.3
尿常规
蛋白
葡萄糖
镜检
红细胞
镜检
白细胞
1+
3+
阴性
阴性
免疫球蛋白游离轻链(FLC)
血清κ(mg/L)
血清λ
(mg/L)
尿κ
(mg/L)
尿λ
(mg/L)
免疫固定电泳(IFE)
血清
尿
>250
180.39
> 250
> 250
未见异常
未见异常
血生化
白蛋白
(g/L)
球蛋白
(g/L)
肌酐
(μmol/L)
eGFR
(ml/min)
尿素
(mmol/L)
尿酸
(μmol/L)
肝功能
29.1
53.6
668.2
7.3
24.47
342
均正常
钙
(mmol/L)
镁
(mmol/L)
磷(mmol/L)
钾(mmol/L)
钠(mmol/L)
CO2CP
(mmol/L)
CRP
(mg/L)
1.84
0.63
2.13
2.75
134.6
12.2
31.64
血气分析
pH
pCO2
pO2
sO2
HCO3-
BE
总CO2
7.31
26
106
98%
13.1
-13.2
13.9
结核
痰涂片找抗酸杆菌(3次)
结核T细胞斑点试验(T-SPOT.TB)
痰Xpert MTB
均阴性
++
阴性
其他
自身抗体
血管炎
相关抗体
CA 125
(U/mL)
CA 199
(U/mL)
ESR
(mm/h)
铁蛋白(ng/ml)
BNP
(pg/ml)
阴性
阴性
32.70
44.67
41.0
507.7
65
粪隐血
凝血功能+DD
其他肿标
阴性
均正常
均正常
入院后检查:
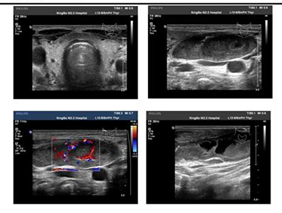
肾脏B超:左肾大小 116×54mm,右肾大小 119×50mm,双肾形态饱满,回声减低且不均匀。
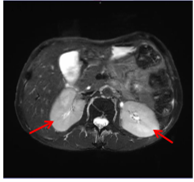
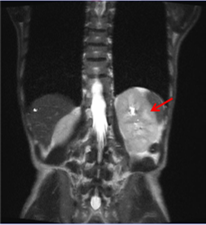
肾脏MRI:双肾增大(下图:红色箭头)。
颈部超声:双侧颈部多发肿大淋巴结(最大者右侧 44×15mm,左侧 55×18mm),考虑为淋巴结核,部分液化。
颈部淋巴结活检:肉芽肿性病变伴坏死:抗酸染色(+ 弱阳性)、六胺银染色(-)、过碘酸 - 雪夫氏糖原染色(-),IgG(+), IgG4(+少量),IgG4/IgG<10%。
结核分枝杆菌(MTB)rpoB 基因及突变检测(Xpert MTB)阳性(+)。
肾活检:
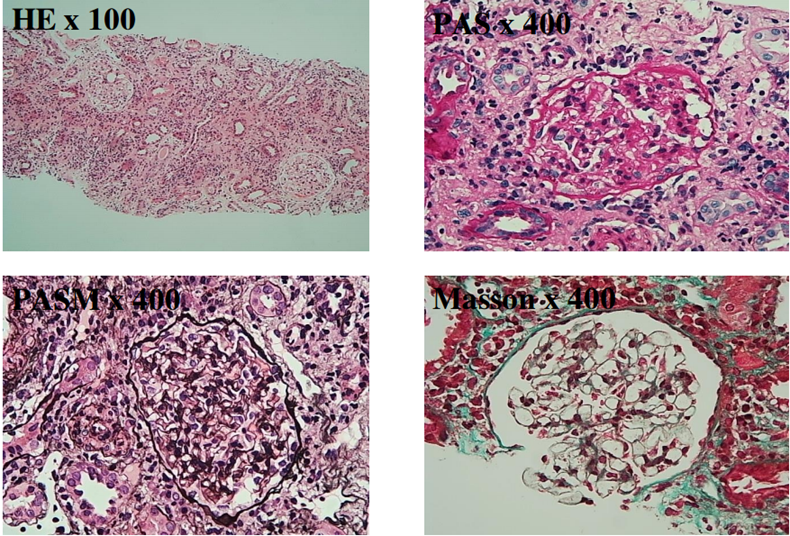
光镜:常规做HE、PAS、PASM、Masson染色,主要为肾皮质,可见11个肾小球,未见肾小球球性硬化及节段性硬化。
肾小球系膜细胞和基质轻度增生,无明显局灶节段性加重,系膜区无明显嗜复红蛋白沉积,毛细血管袢开放,基底膜无明显增厚,未见钉突样结构,无系膜插入及双规形成,上皮下、内皮下无明显嗜复红蛋白沉积,壁层上皮细胞无明显增生,未见新月体形成。
肾小管上皮细胞颗粒变性,可见少量蛋白管型及颗粒管型,部分肾小管管腔扩张,刷毛缘消失,个别肾小管萎缩,肾间质水肿,多灶状及片状炎症细胞(以淋巴细胞和浆细胞为主,伴散在中性粒细胞)浸润,无明显纤维化,小动脉管壁轻度增厚。
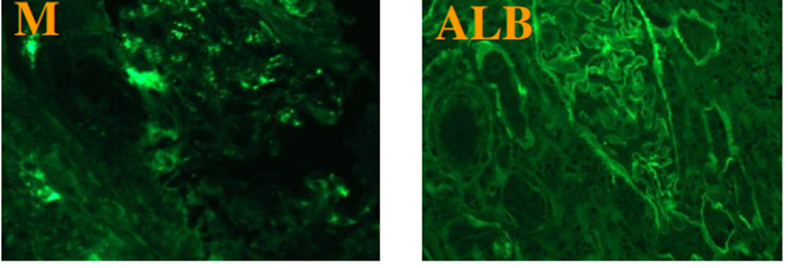
免疫荧光:IgG(-);IgA(-);IgM(+/-);C3(-);C1q(-);Fib(-);ALB(-);kappa(-);lambda(-);AA(-);IgG1(-);IgG2(-);IgG3(-);IgG4(-);PLA2R(-);THSD7A(-)
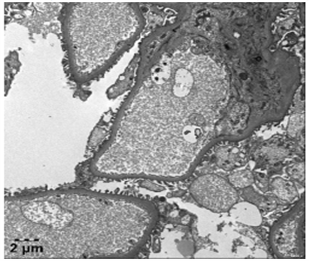
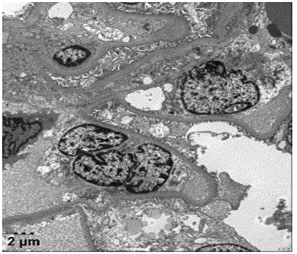
电镜:镜下检测到1个肾小球
毛细血管内皮细胞明显空泡变性,个别管腔内可见红细胞,无明显内皮细胞增生,毛细血管袢开放。肾小囊壁层无明显增厚,壁层细胞空泡变性,无明显增生。
基底膜:节段性增厚,厚度约230-600nm,节段性皱缩。
脏层上皮细胞:上皮细胞肿胀,空泡变性,足突节段性融合。
系膜区:系膜细胞和基质增生。未见确切电子致密物沉积。
肾小管-间质:肾小管上皮细胞空泡变性,少数肾小管上皮细胞脱落。肾间质少量炎症细胞浸润。
肾间质血管:个别毛细血管管腔内可见红细胞聚集。
病理诊断:
符合急性间质性肾炎,肾间质可见大量浆细胞,建议临床注意排查IgG4相关肾损伤。
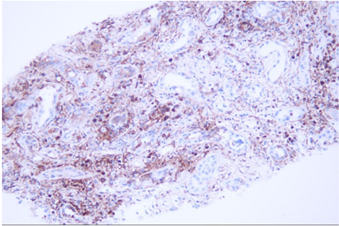
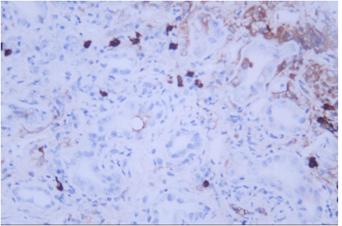
免疫组化:CD38:肾间质多灶状细胞阳性;IgG:肾间质灶状细胞阳性,IgG4:肾间质小灶状细胞阳性,局灶>10个/HP,IgG4/IgG浆细胞比率>40%
病史特点:
v 中年男性,急性起病;颈部淋巴结结核病史,近期抗痨治疗;
v 肾脏表现:急性肾损伤(少尿,血肌酐升高);非白蛋白性蛋白尿;肾活检提示:急性间质性肾炎,IgG4相关性肾病
v 肺部表现:急性血行播散性肺结核
v 实验室检测提示:高球蛋白血症,白/球比倒置;血IgG,IgG4升高
v 游离轻链水平升高;血清κ/λ比值异常,但免疫固定电泳未检测到单克隆蛋白
v 电解质酸碱紊乱:低钾血症、低钙血症、高磷血症,代谢性酸中毒
v 血液系统:中度贫血、血小板减少
【诊疗经过】
诊断:
1.急性血行播散性肺结核
2.急性肾损伤
IgG4相关肾病 (IgG4-RKD)
3.颈淋巴结结核
4.电解质紊乱
低钾血症
低钙血症
高磷血症
5.代谢性酸中毒
6.血小板减少
7.中度贫血
8.高血压
治疗:
1) 抗结核治疗:莫西沙星(0.4g,每日一次)、异烟肼(0.3g,每日一次)、利奈唑胺(0.6g,每日一次)、利福喷丁(0.45g,每 72 小时一次)。半年后停用莫西沙星和利奈唑胺。
2) IgG4-RKD治疗:确诊后予泼尼松治疗(第一个月30mg/d,之后每2周减量至5mg/d)。目前泼尼松5mg/d维持。
3) 其他治疗:降压:氯沙坦钾片 50mg 早上1次 口服;护肝:双环醇片 1片 一日3次 口服。
转归:
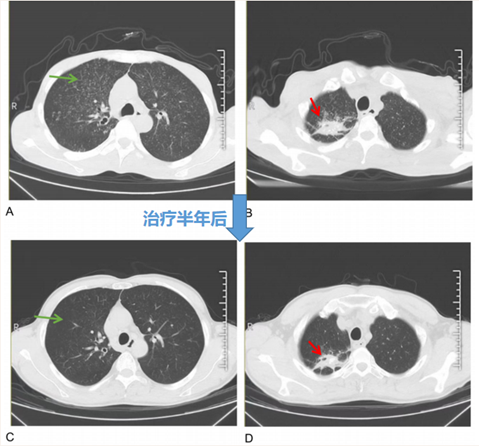
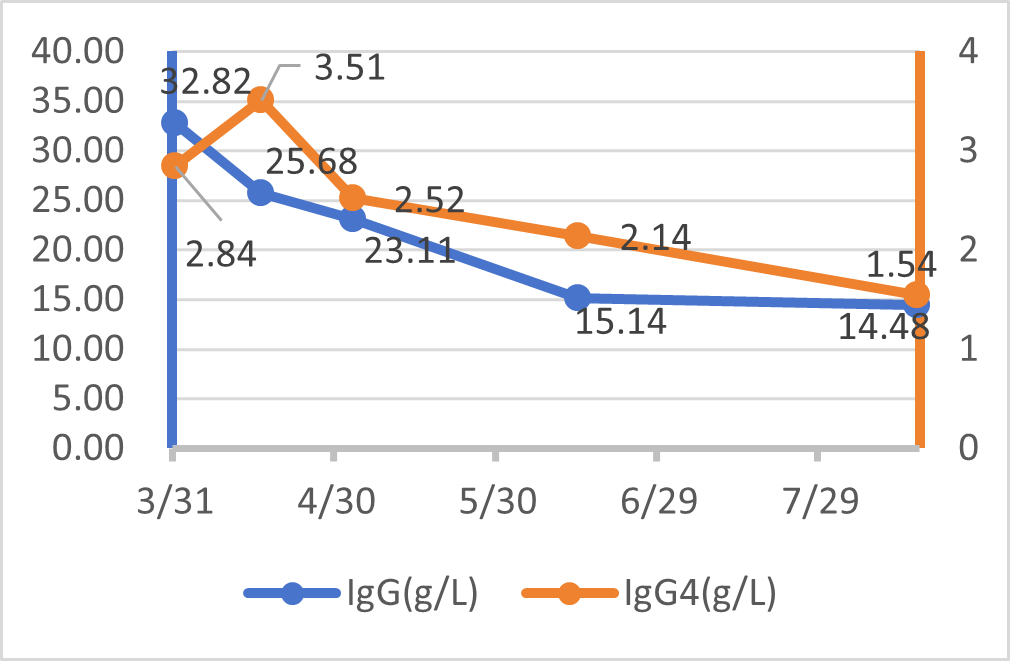
治疗半年后,IgG4(1.11 g/L)、肾功能(血肌酐93.6μmol/L)、尿TP/CR (214mg/g)、血清轻链κ/λ(154.35/39.68)及血三系、电解质等化验指标均明显好转;胸部CT提示双肺弥漫性粟粒样改变(A、C 中绿色箭头)几乎完全吸收,右肺上叶多形性病变得到控制(B、D 中红色箭头)。颈部B超提示淋巴结缩小。
【病例讨论】
1. IgG4相关性疾病与肺结核可能存在关联
IgG4相关性疾病(IgG4-RD)是一种免疫介导的纤维炎性疾病,多见于中老年人群,男女患病比例约为8:3[1]。其组织病理学主要表现包括以IgG4阳性浆细胞为主的淋巴浆细胞浸润,以及腹膜后纤维化、眼眶假瘤等特异性组织纤维化。IgG4-RD可分为增殖型和纤维型两种表型。由于这两种表型可能同时存在,通常难以对其进行区分。
近年来,已有研究报道IgG4-RD与肺结核存在关联。肺结核与IgG4-RD的临床表现可先后出现或同时发生,且可累及多个器官。Qing等报道的一项单中心研究表明,47例IgG4-RD患者中,36.2%(17/47)合并活动性肺结核或潜伏性结核感染[2]。但大多数合并IgG4-RD的肺结核病例以纤维型表型为主,如腺体、眶周、腹膜后组织或淋巴结的纤维化。
本文中,我们报告一例罕见病例:增殖型表型的IgG4-RKD合并急性血行播散性肺结核。患者经泼尼松联合抗结核药物治疗后,结核症状及肾功能均好转。
2. 鉴别诊断:
1) 肺结核 vs. IgG4相关性肺病(IgG4-RLD):IgG4-RLD的临床表现和肺部影像学表现具有多样性,且缺乏特异性。IgG4-RLD的初始影像学表现与肺结核相似,甚至可能模拟肺结核的表现[3]。因此,IgG4-RLD常被误诊为肺结核、肺炎、肺部肿瘤、间质性肺炎等疾病。当肺结核合并IgG4-RD时,早期诊断尤为困难[4]。组织病理学检查是明确诊断的关键。遗憾的是,由于患者拒绝,未进行肺活检。但患者存在咳嗽、夜间发热症状,且结核相关检查(如T-SPOT.TB、Xpert MTB、颈部淋巴结抗酸染色)均为阳性,同时存在淋巴结核表现及急性粟粒性肺结核的影像学改变,这些均支持肺结核的诊断。
2) 肺结核合并急性肾损伤的鉴别:该患者首先通过影像学检查排除了肾后性梗阻因素。入院前患者存在恶心、食欲减退症状,提示可能为肾前性急性肾损伤。患者曾使用利福平、吡嗪酰胺等具有肾毒性的抗结核药物,这也可能是导致急性肾损伤的原因之一。有研究报道,超过半数的抗结核治疗相关急性肾损伤发生在治疗初始2个月内[5]。本病例中,患者接受抗结核治疗后出现食欲减退,同时伴有低白蛋白血症、贫血、血小板减少,这些都是抗结核药物相关急性肾损伤常见的实验室表现,但最终通过肾活检明确:肾活检显示急性间质性肾炎,伴大量浆细胞浸润,以及CD38、IgG、IgG4阳性细胞多灶性间质浸润,IgG4阳性浆细胞计数 > 10个/HP,且IgG4/IgG浆细胞比值> 40%,这些均支持IgG4-RKD的诊断[6]。肾组织病理学检查未发现席纹状纤维化,提示患者处于IgG4-RKD的增殖期[7]。同时,血清IgG4浓度升高及双肾弥漫性增大的影像学表现,也进一步证实了IgG4-RKD的诊断。
3) IgG4-RD vs. 淋巴增殖性疾病:既往研究报道,IgG4-RKD患者的κ和λ游离轻链水平升高[8]。游离轻链被认为是与IgG4-RD疾病活动度及肾脏受累相关的生物标志物。IgG4-RD甚至可能模拟单克隆丙种球蛋白病,这提示B细胞高度活化。本病例中,患者同样表现为非白蛋白蛋白尿、游离轻链及IgG4水平升高、血清κ/λ比值异常,以及高球蛋白血症,但免疫固定电泳未检测到单克隆蛋白。考虑到IgG4-RD可能转化为淋巴增殖性肿瘤,对于存在κ/λ比值异常的IgG4-RD患者,需排除浆细胞增多症及淋巴增殖性肿瘤。随访期间,还需关注患者发生淋巴增殖性疾病的风险。
3. 结核与IgG4-RD两者之间的作用机制:这两种疾病之间的作用机制目前尚不完全清楚,但它们可能存在一些共同的免疫应答。一种假说认为,结核分枝杆菌可激活Th2免疫应答,进而促进IgG4抗体产生,最终导致IgG4-RD的发生[9]。目前研究表明,IgG4-RD在发病过程中可能与结核感染存在一些共同的免疫应答[2]。异常的适应性免疫应答和固有免疫应答均在 IgG4-RD 的发病机制中发挥重要作用[10]。单细胞RNA测序显示,IgG4-RD患者腹膜后组织中B细胞、浆细胞及CD4+T细胞数量增多[11]。研究发现,CD4 +细胞毒性T淋巴细胞可释放白细胞介素-1β、γ干扰素(IFN-γ)及转化生长因子-β1(TGF-β1),参与IgG4-RD的发病过程。另有研究证实,B细胞活化并分化为分泌IgG4的浆细胞,同样参与IgG4-RD的发病机制[12]。而肺结核不仅是一种细菌感染性疾病,也是一种免疫性疾病。在急性期,以 CD4+T细胞和IFN-γ为主导,同时B细胞介导的体液免疫应答也参与其中[2]。然而,这些共同的免疫机制如何相互关联并发挥作用,仍需进一步探索。
4. 结核合并IgG4-RD的治疗:IgG4-RD可能进展为永久性器官功能障碍,这主要取决于疾病被识别和治疗前增殖期的持续时间。因此,早期发现并及时治疗,对于改善器官功能、防止疾病进展为明显的组织纤维化至关重要。迄今为止,糖皮质激素仍是IgG4-RD治疗的基石,被公认为疾病诱导期和维持期的一线治疗药物[13]。近年来,吗替麦考酚酯、硫唑嘌呤、甲氨蝶呤、利妥昔单抗等免疫抑制剂用于治疗IgG4-RD的证据日益增多[14,15]。研究结果显示,免疫抑制治疗可提高治疗效果,可在初始治疗阶段或糖皮质激素减量过程中与糖皮质激素联合使用。本病例中,确诊IgG4-RKD后,我们采用糖皮质激素单药治疗。由于患者为IgG4-RKD增殖型表型,预计其症状对糖皮质激素单药治疗反应良好[6]。抗结核治疗选用莫西沙星、异烟肼、利奈唑胺、利福喷丁等肾毒性较低的药物。患者最终实现IgG4-RKD完全缓解,肺结核部分缓解。需要注意的是,使用糖皮质激素和(或)免疫抑制剂不可避免地会增加机会性感染的风险,尤其是在合并结核感染的情况下。随访期间,需密切监测机会性感染及肺结核活动相关指标。考虑到 IgG4-RD的复发特性,还需对患者进行长期监测。此外,仍需开展高质量的IgG4-RD临床研究,尤其是针对合并肺结核等感染性疾病的病例。
病例报道已征得患者本人同意。
[参考文献]
1. Bateman AC, Culver EL. Challenges and pitfalls in the diagnosis of IgG4-related disease. Semin Diagn Pathol. 2024.41(2):45-53.
2. Qing P, Lu C, Liu Z,et al. IgG4-Related Disease With Tuberculosis: A Case Report and Retrospective Review of Patients in a Single Center. Front Immunol. 2021.12:652985.
3. Erlij D, Ramos D, Montaña J, et al. IgG4-related disease, the new “great mimicker”: Report of one case. Revista médica de Chile. 2014.142(5):646–50.
4. Dragos C, Joseph C, Elwell H, et al. Pulmonary manifestations, treatments and outcomes of IgG4-related disease-a systematic literature review. Rheumatol Int. Published online May 20, 2024.
5. Chang CH, Chang LY, Ko JC, et al. Incidence of and Risk Factors for Acute Kidney Injury During Antituberculosis Treatment: A Prospective Cohort Study and Literature Review. Infect Dis Ther. 2023.12(3):919-931
6. Gilani SI, Buglioni A, Cornell LD. IgG4-related kidney disease: Clinicopathologic features, differential diagnosis, and mimics. Semin Diagn Pathol. 2024.41(2):88-94.
7. Katz G, Hernandez-Barco Y, Palumbo D, et al. Proliferative features of IgG4-related disease. Lancet Rheumatol. 2024.6(7):e481-e492.
8. Lu C, He D, Wang R, et al. Elevated polyclonal IgG4 mimicking a monoclonal gammopathy in IgG4-related disease-a case-based review. Clin Rheumatol. 2024.43(9):3019-3028.
9. Xu J, Zhai J, Zhao J. Pathogenic roles of follicular helper T cells in IgG4-related disease and implications for potential therapy. Front Immunol. 2024;15:1413860.
10. Hao Q, Sun M, Liu Y. The spectrum of B cells in the pathogenesis, diagnosis and therapeutic applications of immunoglobulin G4-related disease. Clin Transl Immunology. 2023.12(12):e1477.
11. Ji Z, Lu W, Wu S, et al. Single-Cell RNA-Sequencing Reveals Peripheral T Helper Cells Promoting the Development of IgG4-Related Disease by Enhancing B Cell Activation and Differentiation. Int J Mol Sci. 2023.24(18):13735.
12. Motta RV, Culver EL. IgG4 autoantibodies and autoantigens in the context of IgG4-autoimmune disease and IgG4-related disease. Front Immunol. 2024.15:1272084.
13. Alsalamah NI, Alhrabi B, Alhumaily N, et al. Efficacy and Safety of Glucocorticoid Monotherapy Versus the Combination of Glucocorticoid and Immunosuppressive Agents for Immunoglobulin G4-Related Disease: A Systematic Review and Meta-Analysis. Cureus. 2023.15(10):e47099.
14. Lanzillotta M, Fernàndez-Codina A, Culver E, et al. Emerging therapy options for IgG4-related disease. Expert Rev Clin Immunol. 2021.17(5):471-483.
15. Lanzillotta M, Stone JH, Della-Torre E. B-Cell depletion therapy in IgG4-related disease: State of the art and future perspectives. Mod Rheumatol. 2023.33(2):258-265.